Hola de nuevo ucieros
hoy quiero compartir con vosotros el intento de resolver las dudas que nos genera la toma de muestras para hemocultivos, bastante habitual en nuestras UCIS
Muestra de ello es el artículo que sigue
*Enfermeras de Unidad de Urgencias y Unidad de Especialidades Quirúrgicas. Hospital General Nuestra Señora del Prado. Talavera de la Reina. Toledo.
En sus conclusiones se observaba la enorme variabilidad de las técnicas empleadas para la obtención de las muestras de Hemocultivos, y se recomendaba la aplicación de un protocolo que identificara el procedimiento correcto en esta técnica, eminentemente enfermera.
El equipo investigador anexaba un protocolo, en el que recogían un buen numero de recomendaciones y que puedes consultar aquí.
Por ello vamos a revisar en el blog algunos protocolos y manuales al respecto, y extraer posteriormente las conclusiones con las recomendaciones con más peso, para intentar unificar el criterio sobre los puntos clave de la extracción de muestra para hemocultivos por enfermería.
En primer lugar el escueto pero completo protocolo de Urgencias Donostia en el que se establecen pautas muy concretas.
Protocolo Hemocultivos Hospital Donostia
Valoramos también el protocolo alojado en un clásico referenciado en este blog, el Consorcio Hospitalario Provincial de Albacete, validado en 2011 según la evidencia existente, y que introduce un factor importante para enfermería y el riesgo biológico:
No cambiar de aguja cuando se introduzca la sangre en los frascos de hemocultivos ya que el cambio de agujas no disminuye la tasa de contaminación y sí aumenta el riesgo de pinchazo.
Puedes descargar el documento haciendo click aquí: protocolo HEMOCULTIVOS CHOSPAB
Seguimos con los protocolos consultados para la realización de este post con el que se realizó en el Hospital Universitario de VALME, en la Unidad Clínica de Enfermedades Infecciosas y Microbiología, dependiente del Servicio Andaluz de Salud, revisado en Junio de 2011, que es probablemente de los más completos de los que puede disponerse, y que introduce nuevas variables, cuatro realmente importantes:
1. La toma de muestras sanguíneas para hemocultivo a través de un catéter venoso central (CVC) únicamente está permitida en los siguientes casos:
- Pacientes con imposibilidad absoluta de acceso venoso o arterial periférico.
- Paciente con trastornos muy graves de la coagulación que contraindiquen una punción venosa o arterial periférica.
- Orden médica del Médico responsable (sospecha de bacteriemia asociada a catéter)
2. Identificar los frascos teniendo la precaución de no marcar o colocar la etiqueta de identificación del paciente sobre el código de barras ni tapando el fondo de los frascos. Los datos de identificación son: el nombre completo del paciente, fecha, número de historia clínica, hora de toma y número de secuencia. Marcar los frascos en la habitación/box del paciente.
3. Orden de rellenado de los frascos:
- Si la extracción se realiza con jeringa, introducir: primero 10 mL de sangre en el frasco de anaerobios y a continuación los 10 mL restantes en el frasco de aerobios. Existe controversia en el cambio de aguja al introducir la sangre en el frasco de hemocultivo, no está claro que disminuya la tasa de contaminación, pero si aumenta el riesgo de pinchazo accidental.
• Si se usa «palomilla» introducir primero 10 mL de sangre en el frasco de aerobios y a continuación los 10 mL restantes en el frasco de anaerobios.
• Mezclar suavemente los frascos utilizando la técnica de inversión.4. Si no pueden ser enviados inmediatamente al laboratorio se mantendrán a “temperatura ambiente”. El tiempo máximo que pueden permanecer a temperatura ambiente antes de ser introducidos en el sistema no ha sido definido con exactitud,
pero nunca debe superar las 18 h.Los hemocultivos nunca deben ser refrigerados.
Puedes descargar el protocolo, altamente recomendable y con un infograma incluido, haciendo click aquí: Protocolo_Extraccion_Hemocultivos_2011
Por último las Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (Editores: Emilia Cercenado y Rafael Cantó), que recoge la mayoría de las respuestas que los enfermeros y enfermeras nos hacemos a la hora de recoger muestras para Hemocultivos: seimc-procedimientomicrobiologia3a
HEMOCULTIVOS: CUÁNDO
Lo más próximo posible al pico febril, y preferiblemente previo a la instauración de la antibioterapia.
Lo habitual es que los facultativos dejen una petición solicitando hemocultivos si fiebre > 38ºC en nuestra unidad cuando el paciente inicia un episodio de febrícula >37,5 ºC.
HEMOCULTIVOS: CUÁNTOS
El número de extracciones considerado óptimo para la documentación de un episodio de bacteriemia es de 2 a 3, utilizando siempre lugares diferentes de venopunción.
De este manera logran detectarse más del 95% de las bacteriemias.
Lo habitual en nuestra unidad es la realización de dos extracciones x dos viales (aerobio y anaerobio) cada una, espaciadas 30 minutos entre ellas, aunque algunos estudios difieren de este extremo.
No se recomiendan extracciones separadas por periodos de tiempo concretos. Al contrario, un estudio ha demostrado que se obtienen similares resultados cuando se extraen los hemocultivos simultáneamente.
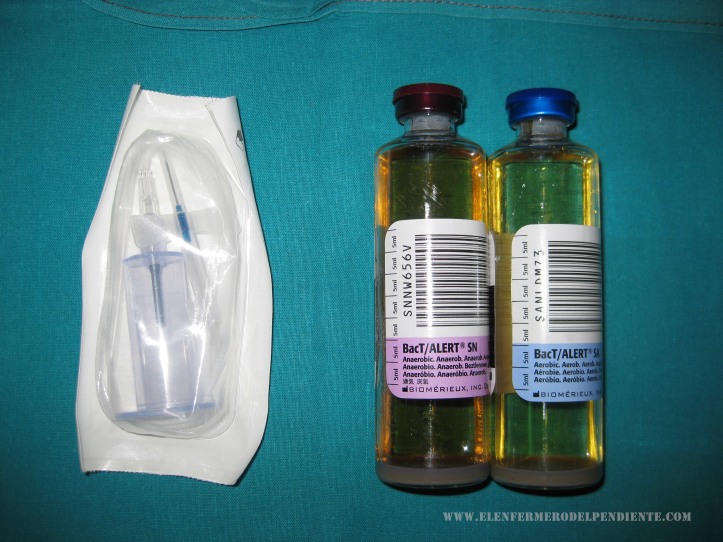
Cada vial tiene un código de color y rotulación de qué tipo de medio contiene, anaerobio y aerobio.
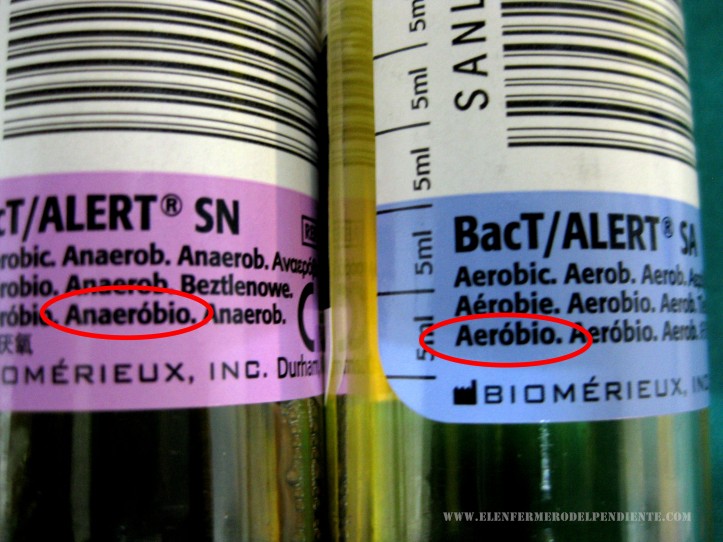
HEMOCULTIVOS: QUÉ CANTIDAD DE SANGRE.
Debemos conocer perfectamente el tipo de viales que utilizamos para el cultivo, pero lo habitual en adultos es emplear 10ml de sangre en cada vial, que contiene unas marcas laterales para controlar la cantidad añadida.
Se considera que el índice de positividad aumenta entre el 3-5% por cada mililitro adicional de sangre cultivada. Sin embargo, la recomendación de elevar el volumen de sangre por extracción no se aplica, en cierta medida por la anemia que se puede provocar al paciente y para mantener la proporción de volumen sangre/medio de cultivo.

HEMOCULTIVOS: ¿QUÉ VIAL RELLENO ANTES?
Dependerá si la extracción se realiza mediante aguja y jeringa o si se realiza medinate sistema de campana adaptadora y palomilla (que contiene aire en su interior y que será trasladada al primer vial que se conecte al sistema de extracción)
Se inoculará en primer lugar el frasco anaerobio, evitando la entrada de aire, seguido del aerobio, invirtiéndolos varias veces para mezclar la sangre y el medio de cultivo.
Por lo tanto
- Si la extracción se realiza con jeringa, introducir: primero anaerobios y a continuación aerobios.
- Si se usa “palomilla” introducir primero aerobios y a continuación anaerobios.
HEMOCULTIVOS: CONSERVACIÓN Y LABORATORIO
Los frascos, con su debida identificación, deben transportarse al Laboratorio inmediatamente. Sólo deben mantenerse a temperatura ambiente durante cortos periodos de tiempo para no afectar la posterior recuperación de los microorganismos. Los hemocultivos que van a ser procesados en sistemas automáticos pueden mantenerse a temperatura ambiente o a 35-37ºC. El tiempo máximo que pueden permanecer a temperatura ambiente antes de ser introducirlos en el sistema no ha sido definido con exactitud, pero nunca debe superar las 18 h.
En general, no se rechazará nunca (por laboratorio) un hemocultivo dada la importancia del diagnóstico de la bacteriemia, salvo en el caso en que haya serias dudas en cuanto a la identificación de la muestra o los frascos estén dañados y contaminados. En el caso de graves deficiencias en el envío de la muestra se contactará con el servicio que la remite para solucionarlas y después se procesará.
Por último comparto el póster de técnica de obtención de muestra de la casa farmacéutica biomerieux que suministra los viales en nuestra unidad, donde se completa y aglutina casi todas estas recomendaciones.
- PREPARACION DE LA PIEL
2. PREPARACION DE LOS VIALES
Importante: hay que desinfectar los tapones y comprobar el sensor (¿sabíais que hay un sensor?), pues éstos no son estériles.
3. EXTRACCION DE LA MUESTRA
4. RECOMENDACIONES
Puedes descargar el poster íntegro aquí: Poster_BacT_ALERT2
Un aporte del gran Miguel Garvi (@miguel_garvi) sobre orden de llenado de los tubos, abundando en el procedimiento de utilización si posterior a los hemocultivos se realiza una extracción analítica convencional (gracias Miguel)
Espero que haya clarificado la mayoría de las dudas, y que os sea de utilidad en vuestras unidades.
Recordemos que, tras la petición del médico, la correcta realización de este procedimiento es exclusivamente nuestra.
Saludos
@uciero
(Ultima actualización: 12 enero 2016)






Pedazo de revisión Isidro, muy completa. Por fin una referencia bibliográfica sobre el orden de tubos en las extracciones, magnifico aporte del gran Miguel Garvi.
Aprovecho para felicitarte por tu blog, todo un referente para la enfermería.
Enhorabuena!!!
Un abrazo!!!
Muchas gracias victor!
Un abrazo
Isidro
Corroboro el comentario de Victor, fantástica entrada, muchas cosas aclaradas.
Sigue así, tu blog es necesario!
Saludos.
Patricia.
Muchas gracias patricia!
Me alegra mucho ser de utilidad a los compañeros y clarificar dudas, pues esa es la voluntad del blog.
Saludos!
Isidro
Hola ceeci Lic. Juan Carlos Toledo ICBA_ buenos aires argentina..
En la preparacion de la piel, la forma de dar circulos concentricos alrededor de l sitio de puncion … no aumenta la colonizacion… NOsotros realizamos un estudio donde comparabamos la toma del hemocultivo preparando la piuel segun tu recomendacion vs. Limpoiar la piel con alcohol y luego clorhexidina pasando una casa en cada pasada. siempre en un mismo sentido.. y la verdad pudimos demostrar que los falsos positivos con germenes de la piel fue mucho menos.
Por otro lado y en el mismo meomento tambien cambiabamos la aguja…
gracias muy buen trabajo.
Hola Juan Carlos!
muchas gracias por tu aporte, realmente interesante. Sobre el cambio de aguja, parece que las recomendaciones apuntan a que no afecta a la contaminación de la muestra y sí aumenta el riesgo de pinchazo accidental, por lo que sugieren trasladar la muestra con la misma aguja de la punción.
Saludos compañero!
isidro
Hola!
Enhorabuena y gracias por esta revisión. La última duda que me queda es: Después de la extracción hay que enviar los frascos con la goma tapada o protegida para evitar su contaminación?
Gracias, un saludo.
Muchas gracias Juana, por tu comentario!
Ciertamente, no existe nada en la literatura acerca de proteger o no la goma puncionada, aunque he visto que en algunos sitios colocan una gasa con clorhexidina sujeta con esparadrapo… habrá que esperar los estudios al respecto…
Lo que sí se indica respecto al trasporte al laboratorio es que «los frascos, con su debida identificación, deben transportarse al laboratorio inmediatamente. Sólo deben mantenerse a temperatura ambiente durante cortos periodos de tiempo para no afectar la posterior recuperación de los microorganismos.
Si no pueden ser enviados inmediatamente al laboratorio se mantendrán a
“temperatura ambiente”. El tiempo máximo que pueden permanecer a temperatura ambiente antes de ser introducidos en el sistema no ha sido definido con exactitud, pero nunca debe superar las 18 h. Los hemocultivos nunca deben ser refrigerados»
Saludos y gracias de nuevo
isidro
Hola!!! Por que con palomilla hay que llenar primero los aerobios? Un saludo, y muchisimas gracias por tus publicaciones!! 👍
Hola Rocío! Gracias a ti por pasar y comentar…
Parece que el motivo es que en el sistema de la palomilla hay aire que inevitablemente se introduce en el primero de los viales. Para el segundo el sistema ya está purgado.
Saludos!
Isidro
[…] ¿Qué tuvo lleno primero? / Orden de llenado de tubos (Creative Nurse). Fuente texto: Hemocultivos para Enfermeria: revision (Isidro Manrique) / Orden de llenado de tubos de muestras sanguíneas (Oscar […]
No suelo comentar en páginas, pero es que he entrado en este artículo de casualidad y no podía irme sin decir que me parece increíble, no solo este artículo, sino toda la página. La cantidad de horas que debes haberle echado… Se notan las ganas, la dedicación y sobretodo la VOCACIÓN. Enhorabuena muy buen contenido. 😀
muchísimas gracias isanisa!
sólo pongo mi granito de arena… y es un privilegio recibir mensajes como el tuyo…
gracias de verdad!!!
isidro
Hola!! Una duda que me ha quedado… si realizo la extracción con palomilla y lleno primero el frasco con aerobios, existe después contaminación en el frasco anaerobio? Me imagino que, la proporción será menor que si lleno primero el frasco de anaerobios?
Gracias por el post 🙂
Hola María! Si empleamos técnica estéril no debe haber contaminación… Si te refieres a entrada de aire, la palomilla tel sistema queda purgado con el llenado del primer frasco ( aerobio) donde sí entra el existente en la línea.
Saludos!!!
Isidro
Muy útil, muchísimas gracias. Soy @crisguada en instagram ;).
Muchísimas gracias Cris!!!! 🙌🙌🙌
Hola buenas tardes, según nuestro protocolo de hemocultivos a la hora de utilizar antiséptico para la piel del paciente utilizamos clorhexidina alcohólica al 2%, en menos de 30 segundos puedes realizar la punción. Creo que hoy por hoy es lo más recomendable si no hay problema por la patología del paciente, no te parece??
Muy interesante el blog, felicidades¡¡¡
[…] algun tiempo que publiqué en el blog una revisión sobre Hemocultivos que puedes consultar aquí, y que venía a resolver las dudas sobre esterilidad, manipulación u orden relativo a esta técnica […]
Buenas, muchísimas gracias por tus aportaciones, me surge la duda con la toma de muestras sobre la opción de obtenerlas de punción arterial siempre que sea imposible de vena, me comentan que el hecho de que la sangre sea arterial da falsos negativos, pero no encuentro nada al respecto, salvo que es preferible venosa, y en mi servicio suele ser una práctica habitual. Muchas gracias
Hola
no conozco ninguna evidencia que sostenga que la sangre arterial de falsos negativos.
Generalmente se opta por punción venosa por ser más accesible, menos dolorosa y con menor riesgo de complicaciones.
saludos
isidro
Muy completo el artículo. Estoy armando un material para pediatría y al volver a mi servicio me encuentro con que los frascos que se utilizan para hemocultivos son todos aerobios, no hay frascos anaerobios… ¿por qué? En pediatría que pueden comentar? Gracias. Saludos colegas.
Excelente el blog! comparto.
Hola Soledad!!!
mil gracias por tu comentario. Lo cierto es que deberían haber disponibles aerobios y anaerobios, sin excepción. Hay un post más reciente con un muy buen manual que te puede también ser de utilidad en tu ámbito, te dejo enlace:
https://elenfermerodelpendiente.com/2020/09/07/hemocultivos-guia-de-practica-clinica-enfermera-2020/
Saludos
isidro
Cuando el sitio de proceso es lejano a la unidad médica,
Tras inocular un hemocultivo, puede ser conservado en refrigeración antes de ser trasladado al laboratorio donde será procesado? Y cuánto tiempo es el máximo que puede mantenerse así?
Hola Diana!!!! hay publicado en el blog otra entrada con un manual sobre hemocultivos donde explica todas estas particularidades. Saludos!
Increíble info, me ha encantado!
Gracias!!!