ADSORCIÓN DE ÁCIDO EN CARBÓN ACTIVADO. ISOTERMA DE ADSORCIÓN DE LANGMUIR
Hola amigos integrantes de esta prestigiosa comunidad STEEMIT.
En esta oportunidad quise mostrarles un fenómeno químico muy interesante y es la adsorción de líquidos en sólidos. Para esta experiencia práctica decidí utilizar carbón activado por que tiene la característica de tener una superficie porosa relativamente grande y sabemos que este material presenta muchas aplicaciones tanto químicas como médicas.
INTRODUCCIÓN
Los fenómenos de adsorción sobre espacios de diferentes estados ya sean líquidos o sólidos se caracterizan por mostrar sustancias en determinados lugares. Estas sustancias se denominan adsorbatos mientras que la superficie es el adsorbente. Depende de los estados de estas sustancias existen distintos tipos de interacciones moleculares. En fisicoquímica la adsorción de gases sobre sólidos es de suma importancia estos depende de las condiciones del sistema, como temperatura, presión y concentraciones.
Las fuerzas moleculares situadas en la superficie de un sólido donde las moléculas o iones no tienen satisfechas todas sus fuerzas de unión con otras partículas, reteniéndolas en su superficie se denomina adsorción1
Existen dos comportamientos de adsorción, fisisorción y quimisorción, aunque es frecuente observar comportamientos intermedios. En fisisorción las moléculas se mantienen unidas a la superficie del sólido por medio de fuerzas de Van Der Waals (interacciones dipolares, dispersión y/o inducción). La molécula fisisorbida mantiene su identidad pero son interacciones débiles. Mientras que en la adsorción química o quimisorción las moléculas se mantienen unidas a la superficie formando un enlace químico fuerte.

Figura 1.Fisisorción y Quimisorción
En 1918 I. Langmuir dedujo una ecuación que relaciona la adsorción de átomos en superficies solidas a una presión, concentración y temperatura específica y constante en un medio cualquiera. La isoterma se estableció empleando un modelo simplificado de la superficie de un sólido:
La superficie de un sólido presenta un cierto número de posiciones para la adsorción y todas son iguales.
sólo se adsorbe una partícula en cada lugar.
Las moléculas adsorbidas no interaccionan entre sí2
La adsorción se ve reflejada de la siguiente manera4
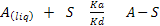 Ec 1.
Ec 1.
A es el adsorbato y S el adsorbente ka: contante de velocidad para la adsorción, kd: constante de velocidad para la desorción. Para mostrar el nivel de extensión de la adsorción se introduce la fracción de recubrimiento Ө. Ya que sobre cada posición sólo puede adsorberse una molécula. Y (1- Ө) como la fracción de posiciones vacías sobre el absorbente. La velocidad de absorción es proporcional a la concentración y a la fracción de posiciones desocupadas, mientras que la velocidad de desorción es proporcional a Ө. Estas son iguales5
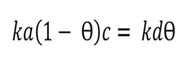 Ec 2
Ec 2 Resolviendo Ө se obtiene la isoterma de Langmuir
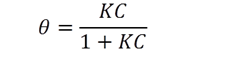 Ec 3
Ec 3 Donde K = ka/kd es el coeficiente de adsorción. es la parte de los lugares ocupados es igual a X / N, donde X es el número de moles de soluto que ya se adsorbió por gramo de adsorbente y N es el número de moles que puede cubrir la superficie del adsorbente. Sustituyendo en la ecuación (3) tenemos:
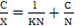 Ec 4
Ec 4 Incluyendo lo explicado con anterioridad en el presente post tiene como objetivo argumentar, el estudio de la isoterma de Langmuir, a partir de la determinación de la capacidad absorbente del carbón activado.
PARTE EXPERIMENTAL
Se pesó aproximadamente 1 g de carbón activado y carbón no tratado con una exactitud de ± 0,1 mg en cada uno de cinco matraces Erlenmeyers de 125 mL. Se agregó a cada uno de ellos 50 mL de una disolución de ácido acético de la siguiente forma: al primero 50 mL de la disolución 0,4 M, al segundo 30 mL de la disolución 0,4 M y agua, al tercero 15 mL de la disolución 0,4 M y agua, al cuarto 10 mL de la disolución 0,4 M y agua y al quinto 5 mL de la disolución 0,4 M y agua. Luego se mantuvo en agitación constante 1 hora a temperatura constante.
Luego se filtró las disoluciones con papel de filtro fino y se titularon los filtrados con hidróxido de sodio 0,1 M, empleando fenolftaleína como indicador. Para cada valoración se tomaron alícuotas de 10 ml de las cinco disoluciones y se efectuaron titulaciones por duplicado a temperatura ambiente.
RESULTADOS Y DISCUSIÓN
Para analizar la adsorción del ácido acético sobre el carbón activado, también se hizo el experimento sobre carbón sin tratamiento térmico para hacer una comparación de los resultados. Arrojando los siguientes resultados:
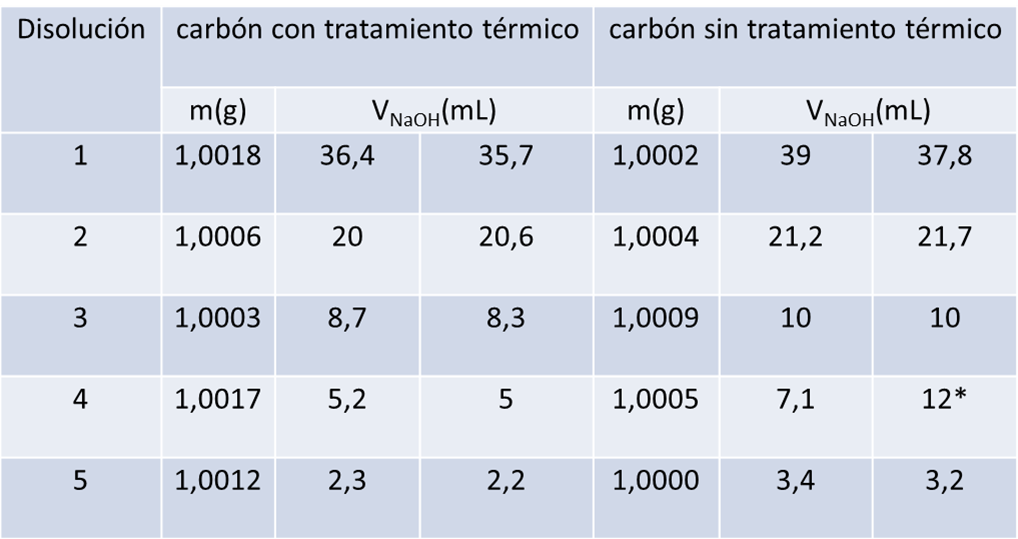
- La muestra 4 presento error.
Con los datos de la Tabla 1, se hallan los valores de la isoterma de Langmuir como son la concentración del adsorbato en el equilibrio (c), el número de moles adsorbidos por gramo de adsorbente (X), y la relación de estas dos últimas (C/X). Con la concentración del hidróxido de sodio, y con la concentración de cada dilución. En la Tabla 2 los resultados.
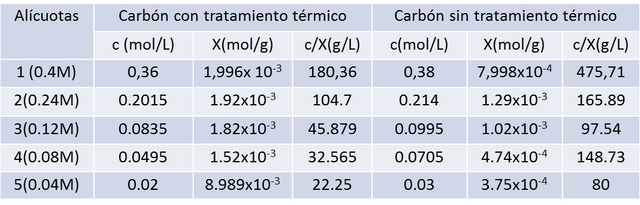
La concentración en la superficie depende de la concentración de la fase liquida, de la temperatura, del tipo y extensión de la superficie y de la naturaleza del sistema reaccionante.. Dicho esto se puede referir a los datos de la Tabla 2, donde a medida que la concentración de las diluciones de ácido acético disminuye, y a su vez decrece la concentración en el equilibrio, y con ella el número de moles adsorbidos por gramo de adsorbente denominado como X, es decir, mientras más concentrado se encontraba la solución de ácido acético, más moles fueron adsorbidos en el carbón por medio de fuerzas de atracción del tipo dipolo/dipolo, fuerzas de London o fuerzas de Van Der Waals.
Se diferencian las propiedades del carbón activado de las del no tratado, al observar la cantidad de moles adsorbidos por ambos, donde en el carbón no tratado fue menor en todos los casos. Esto se debe a que el carbón activado tiene una gran área ó superficie favorable para que puedan interactuar las moléculas de la sustancia que se adsorbe, Este repentino cambio en la estructura interna del material provoca un gran número de huecos de tamaño microscópico, cuya superficie es propensa a la retención de moléculas con una cierta estructura. Esta superficie se alcanza cuando el material se somete a altas temperaturas y se introduce rápidamente vapor de agua, nitrógeno, argón, dióxido de carbono o algún otro gas inerte. 7
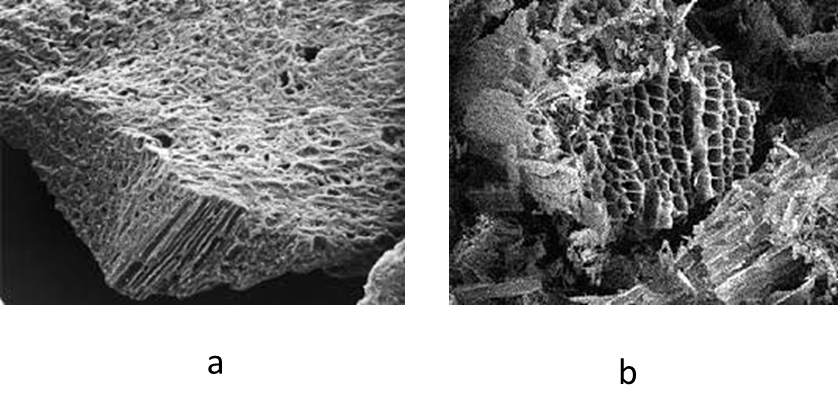 Figura 2. Superficie del Carbón activado a. b
Figura 2. Superficie del Carbón activado a. b I. Langmuir dedujo la isoterma Tipo I empleando un modelo simplificado de la superficie de un sólido; La superficie proporciona un cierto número de posiciones para la adsorción y todas son equivalentes, sólo se adsorbe una molécula sobre cada posición,- su adsorción es independiente de la ocupación de las posiciones vecinas (las moléculas adsorbidas no interaccionan entre sí). 2 que cumple con su ecuación.
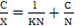 Ec 4
Ec 4 Esta ecuación el principio de la ecuación de la línea recta, es decir su representación de c/X vs c debe dar una recta con pendiente 1/N. como se muestra seguidamente.
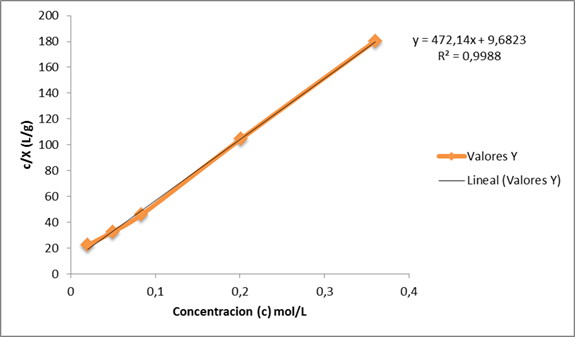
Gráfico 1. Isoterma de adsorción del ácido acético sobre el carbón activo tratado- Fuente elaboación propia
El valor de R2 es el coeficiente de correlación de Pearson, una medida estadística considerablemente utilizada que establece el grado de relación lineal entre dos variables aleatorias. El coeficiente de correlación debe estar en el intervalo de más o menos 1. 8 e indica que si se encuentra cercano a 1 se puede utilizar la ecuación de una línea recta. Por lo que es válido en nuestra gráfica.
En consecuencia se puede calcular los valores de N y K que son el número de moles por gramos necesarios para cubrir toda la superficie y el coeficiente de adsorción respectivamente a partir de la ecuación dan como resultado N=2.11x10-3 mol/g y K=48.94L/mol
Y a su vez la isoterma para el carbón no tratado arrojo los siguientes resultados N= 9.38x0 -4 mol/g y K=43.82L/mol para la siguiente gráfica. Pero estos datos no se toman en cuenta ya que para llevar a cabo la isoterma de Langmuir debe de ser una línea recta y en efecto esta isoterma no lo es. Esto debido al que el carbón no tratado no presento una adsorción favorecida
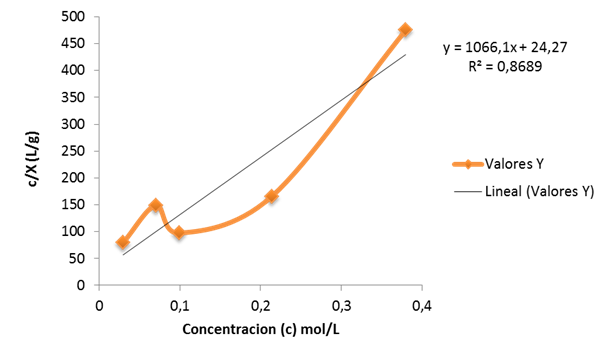
Gráfico 2. Isoterma de adsorción del ácido acético sobre el carbón no tratado-Fuente- Elaboración propia
Para finalizar, se calculó el área específica del carbón activado tratado, obteniendo un valor de 266,87 m2 /g que, comparada con el área superficial que se encuentra en la literatura que están alrededor de (500-m2 /g -1500 m2 /g) 7 este valor se encuentra por debajo de lo esperado, debido verosímilmente a adsorción de contaminaciones por parte del carbón.
CONCLUSIONES
El tipo de adsorción realizada durante la práctica fue de tipo Fisisorción, debido a que no hubo reacción química entre los reactivos utilizados, es decir, no hubo formación de enlaces.
La concentración de soluto en equilibrio por número de gramos adsorbidos por gramo de adsorbente. (C/X), disminuye a medida que aumenta la concentración en equilibrio.
A medida que disminuye la concentración del adsorbato disminuye la adsorción sobre el carbón activado.
Los valores obtenidos para el carbón activado fueronN=2.11x〖10〗^(-3) mol/g y K=48.94L/mol
REFERENCIAS
1 Samuel, Maron.Carl, Prutton.1984.Fundamentos de fisicoquímica.14ta Edición. Editorial Limusa.México, España.
3 Gilbert w. Castellan.1974-1987. Fisicoquímica.2da Edición. Editorial Wesley.México.
4 Practica de laboratorio de fisicoquímica II, universidad del Zulia, facultad experimental de ciencias.
5 Luis M. Carballo S. Introducción a la catálisis heterogénea, Universidad nacional de Colombia, facultad de ingeniería sede Bogotá.
7 José, Felipe, Izquierdo. Fidel Cunill .Javier, Tejero, Montserrat, Iborra.Carles, Fité. 2004. Cinética de las reacciones químicas. Ediciones de la Universidad de Barcelona.
Saludos @viannis. En mi laboratorio realizamos una práctica similar con los estudiantes, es muy didáctica para describir el proceso de adsorción. Éxito.