- Glosario
- Infecciones de transmisión sexual
- Exposiciones de biologia
- Actividad Tres
- Dimorfismo Sexual
- Polinización
- Apareamiento y Celo
- Equidad de genero
- Cortejo
- Migración de especies
- Biología Primer Bloque
- Reproducción de anfibios y reptiles
- Reproducción de mamiferos
- Clonación
- Reproducción asexual
- Reproducción sexual
- Reproducción de las plantas
- ADN
- Métodos Anticonceptivos
- Fenotipo y Genotipo
- Potencialidades de la sexualidad humana
- Salpingoclasia y vasectomia
- Embarazo precoz
- Fecundación
- Lecturas para ti
- Asignaturas o Curricula
LOS ESTADOS DE AGREGACIÓN DE LA MATERIA
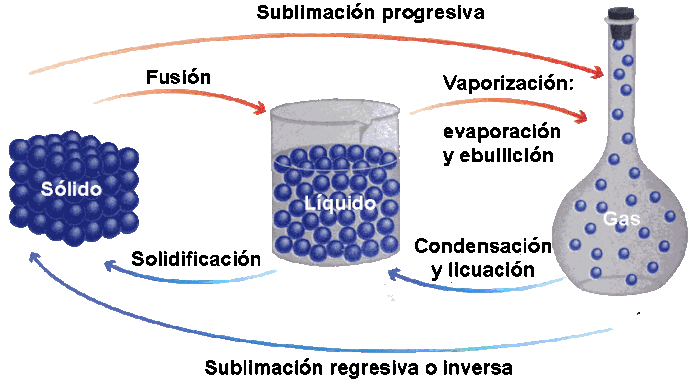

Los Sólidos
Un sólido se caracteriza por la gran fuerza de cohesión entre sus moléculas, lo cual impide cualquier tipo de expansión. Calentados a gran temperatura, la cohesión se debilita y puede convertirse sucesivamente en líquido y gas.
FORMA: tienen forma propia y fija.
VOLUMEN: volumen propio y fijo.
COMPRESIBILIDAD: no pueden comprimirse.
FUERZAS INTERMOLECULARES: En un sólido las fuerzas intermoleculares que predominan son las de ATRACCIÓN.
Como ya mencionamos, un sólido es una sustancia formada por moléculas que se encuentran estrechamente unidas entre sí mediante una fuerza llamada fuerza de cohesión.
La disposición de estas moléculas le da un aspecto de dureza y de rigidez con el que frecuentemente se le asocia.
Los sólidos son duros y presentan dificultad para comprimirse. Esto se explica porque las moléculas que los forman están tan cerca, que no dejan espacios entre sí. Si miras a tu alrededor, notarás que todos los sólidos tienen una forma definida. Esta característica se mantiene, salvo que actúe sobre ellos una fuerza tan grande que los deforme.
La forma definida de los sólidos es producto de la fuerza de cohesión que mantiene unidas a las moléculas.
La diferencia entre los sólidos se debe a propiedades específicas, como las siguientes:
•Elasticidad: Un sólido recupera su forma original cuando es deformado. Un elástico o un resorte son objetos en los que podemos observar esta propiedad. Estira un elástico y observa lo que sucede.
•Fragilidad: Un sólido puede romperse en muchos pedazos (quebradizo). En más de una ocasión habrás quebrado un vaso de vidrio o un objeto de greda. Estos hechos representan la fragilidad de un sólido.
•Dureza: Un sólido es duro cuando no puede ser rayado por otro más blando. El diamante de una joya valiosa o el utilizado para cortar vidrios presenta dicha propiedad

Los Líquidos
A diferencia de las moléculas en las substancias que se encuentran en estado sólido, las moléculas de un líquido no se encuentran tan unidas pero tampoco están tan separadas como las moléculas de un gas.
Otra característica esencial de los líquidos es una resistencia natural al flujo, esta característica es conocida como viscosidad. La viscosidad en un líquido aumenta al aumentarse la presión pero disminuye al aumentar la temperatura.
Propiedades de los líquidos
Tensión superficial. La tensión superficial es la fuerza con que son atraídas las moléculas de la superficie de un líquido para llevarlas al interior y de esta manera poder disminuir el área superficial.
Capilaridad. La capilaridad es una propiedad de los líquidos que depende de su tensión superficial y se trata de un fenómeno en el que un sólido y un líquido entran en contacto.
Viscosidad. Es una propiedad de los líquidos que consiste en una resistencia natural a fluir debido a la distancia que existe entre sus moléculas. La viscosidad de un líquido por lo tanto dependerá de las fuerzas intermoleculares:
Fluidez. Es la característica de los líquidos que les confiere la habilidad de poder pasar por cualquier orificio aun cuando sea muy pequeño siempre que este al mismo nivel o a un nivel inferior del recipiente en el que se encuentra el líquido.
Punto de ebullición. El punto de ebullición de un líquido es la temperatura en la cual la presión del vapor del líquido es exactamente igual a la presión ejercida sobre el líquido (presión atmosférica).

Los Gases
Se denomina gas al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta energía cinética.
Propiedades
Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
Los gases ocupan completamente el volumen del recipiente que los contiene.
Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Esta página web ha sido creada con Jimdo. ¡Regístrate ahora gratis en https://es.jimdo.com!
