Por José Montalva, Luisa Ruz y Mary Kalin Arroyo. Publicado en la Revista del Jardín Botánico Chagual, 2008.
Las invasiones biológicas están entre las principales amenazas actuales a la biodiversidad. Sus efectos más notorios son la modificación de la estructura y del funcionamiento de las comunidades invadidas (Arroyo et al. 2000, Mack et al. 2000, Traveset & Richardson 2006, Aizen et al. 2008, Tylianakis 2008). Aunque cada vez hay más conciencia de este problema a nivel mundial, y a pesar de que en el caso de los polinizadores la llamada crisis de la polinización y las extinciones locales de especies de polinizadores son una alarma (O’Toole 1994, Buchmann & Nabhan 1996, Thorp 1996, Cane 2001, Roubik 2001, Aizen 2002, Biesmeijer et al. 2006, Larson & Frazén 2007), los esfuerzos para solucionar esta problemática aún son insuficientes (Toro 1986, Buchmann & Nabhan 1996, Roubik 2001, Biesmeijer et al. 2006, Traveset & Richardson 2006, Morales 2007, Aizen et al. 2008). Es importante entender que los impactos de las especies invasoras son irreversibles en la mayoría de los casos, por lo que un principio precautorio hacia especies introducidas es una medida que se debiera llevar a cabo aun cuando éstas no se transformen en especies invasoras (Mack et al. 2000, Ruz 2002, Morales 2007).
En el presente artículo se analizan las posibles consecuencias ecológicas de un abejorro de origen europeo en las áreas silvestres de nuestro país, con base en antecedentes y reportes de otros lugares del mundo donde la especie se ha asilvestrado (Dafni & Shmida 1996, Hingston & McQuillan 1999, Goka et al. 2001, Goulson et al. 2002, Hingston et al. 2002, Goulson 2003, Matsumura et al. 2004, Inari et al. 2005, Ings et al. 2005, Goka et al. 2006,
Ings et al. 2006, Kenta et al. 2006, Winter et al. 2006, Morales 2007, Inoue et al. 2008).
ANTECEDENTES DE LA ESPECIE
Bombus terrestris L. (Figura1) es una especie de abeja eusocial de origen paleártico perteneciente a la familia Apidae. Al igual que la abeja Apis mellifera L., es extremadamente
generalista, capaz de forrajear sobre un amplio espectro de flores, con una alta habilidad para utilizar y aprender el manejo de estructuras florales complejas (Laverty 1980, Gegear
& Laverty 1998), en condiciones desfavorables y con una gran capacidad de adaptación a una amplia variedad de ambientes (Hingston et al. 2002, Goulson 2003).
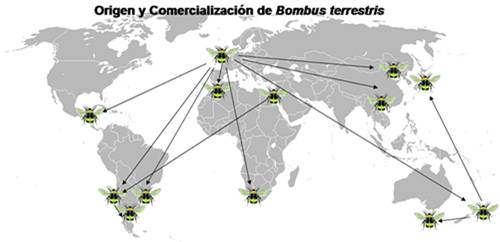
Esta especie también tiene un extenso rango de vuelo, que va de los 2,5 a los 5 km (Dafni 2002, Walter-Hellwig & Frankl 2000, Goulson 2003, Chapman et al. 2003, Baer & Schmid-Hempel 2003). Todas estas cualidades redundaron en su comercialización como insumo
para la polinización de productos hortícolas, lo que permitió que su distribución se extendiera hacia varias partes del globo (Figura 2) (Goulson 2003, Morales 2007).
La primera importación se realizó en 1885: del Reino Unido llevaron a Nueva Zelanda 93 reinas para polinizar trébol rosado, Trifolium pratense L. (Goulson & Hanley 2004). Casi cien años más tarde hicieron lo propio hacia Israel (Dafni & Shmida 1996), pero el boom de las importaciones comenzó en la década de 1990 y los países de destino fueron muy variados: China, Japón, Australia, Sudáfrica, México y Uruguay (Goulson 2003, Hingston et al. 2002, Morales 2007, Inoue et al. 2008) (Figura 2). En el año 2006 se encontraron individuos de B. terrestris forrajeando en la provincia de Neuquén, Argentina. Se piensa que este abejorro llegó a ese país procedente de Chile (Torreta et al. 2006), donde se introdujo en los años 1997-1998 (Ruz & Herrera 2001, Ruz 2002).
Las primeras reinas de B. terrestris fueron traídas a Chile desde Israel y Bélgica, con el objetivo de polinizar tomates Lycopersicum esculentum Mill en invernaderos (Ruz & Herrera 2001, Ruz 2002). Ésta fue la segunda especie del género introducida al país, ya que en 1982-1983 se importó Bombus ruderatus con el fin de polinizar trébol rosado, Trifolium pratense L. (Arretz & Macfarlane 1986, Roig-Alsina & Aizen 1996, Abrahamovich & Díaz 2002, Ruz 2002, Rebolledo et al. 2004, Morales 2007).
En el año 1998 (Fried 1999), y posteriormente en el 2001, este abejorro se comenzó
a utilizar fuera de invernaderos (Olavarría 2003) para evaluar sus servicios de polinización
en pimientos, arándanos y paltos (Fried 1999). Este hecho y la posible fuga de reinas desde los invernaderos se podrían considerar como las principales causas del actual asentamiento
de esta especie en áreas naturales de nuestro país. Hoy existen muchas colonias asilvestradas en numerosas localidades del norte y centro del país, desde la IV Región
a la X Región, y desde el nivel del mar hasta los 3.400 m de altitud (MTK, observaciones personales), en ambientes de alta montaña. Se presume que a corto plazo su distribución
será mucho más amplia, dado que su tasa de invasión alcanza los 10 km² al año según Buttermore (1997) o 25 km² según Hingston y colaboradores (2002).
Con base en estos antecedentes bibliográficos y experiencias en otros lugares del mundo donde la especie se ha asilvestrado, se postula que B. terrestris podría ser una
potencial amenaza a la biodiversidad de las zonas recientemente invadidas.
INFORMACIÓN Y DISCUSIÓN ACERCA DE LAS PRINCIPALES CONSECUENCIAS EN AMBIENTES SILVESTRES
Sobreposición de recursos (florales y nidificación)
B. terrestris forrajea a temperaturas más bajas que la mayoría de las abejas (Dafni & Shmida 1996, Goulson 2003, Hingston et al. 2002) y en promedio se mantiene más tiempo activa durante una temporada. Su actividad diaria comienza más temprano que la de otras especies, y esto le garantiza recursos. Su talla es comparativamente grande (109-315 mg) respecto de la mayoría de las abejas (Dafni & Shmida 1996, Goulson 2003, Hingston et al. 2002), lo que le posibilita no ser desplazada de zonas de forrajeo por otros polinizadores de menor tamaño. Tiene rangos de vuelo amplios y puede acceder a más fuentes de recursos que otras abejas (Dafni & Shmida 1996, Walter-Hellwig & Frankl 2000, Dafni 2002, Hingston et al. 2002, Chapman et al. 2003, Goulson 2003). Un claro ejemplo de esto son los estudios de Dafni, que señalan que B. terrestris alcanzan zonas aisladas después de un incendio (Dafni 2002). Además, el ser una especie social capaz de una mayor comunicación le da ventajas sobre abejas solitarias al momento de localizar fuentes de recursos (Moller 1996, Goulson 2003). Estas características deben ser analizadas en función de la posibilidad de que exista competencia con las especies nativas.
Cabe señalar que en el último tiempo la especie nativa del género, B. dahlbomii ha disminuido sus poblaciones sobre todo en las regiones IV, V, Metropolitana y VI (Ruz &
Herrera 2001, Ruz & Vivallo 2005), precisamente donde B. terrestris es más abundante (Ruz & Herrera 2001); no se sabe si hay una incidencia real del abejorro introducido sobre el nativo. Estudios realizados en Argentina plantean la posibilidad de un desplazamiento de B. dahlbomii por parte de otro abejorro introducido, B. ruderatus (Morales & Aizen 2004, Morales 2007, Madjidian et al. 2008), pero en Chile faltan estudios sobre la materia.
Con respecto a las sobreposiciones en áreas de nidificación, Inoue et al. (2008) plantean que B. terrestris es uno de los principales responsables de las extinciones locales de B. hypocrita sapporoensis en Japón, debido a la usurpación de nidos por parte del abejorro exótico. Aunque de preferencia utiliza madrigueras de roedores desocupadas (Goulson
2003, Matsumura et al. 2004, Morales 2007, Inoue et al. 2008), B. terrestris también se ha visto nidificando en áreas altamente urbanizadas e incluso en murallas de casas (Morales 2007), lo que plantea una flexibilidad en el uso de este recurso por parte de esta especie.
Polinización de plantas exóticas y disrupción de la polinización en plantas nativas
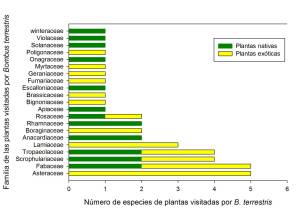
Figura 3. Relación de plantas exóticas versus plantas nativas visitadas por B. terrestris, detallándose a qué familias pertenecen.
Entre los problemas atribuidos anteriormente a este abejorro exótico está la efectividad en la polinización de varias especies exóticas, lo que favorecería su establecimiento y quizás el poder de invasión de las plantas (Stout et al. 2002, Hingston 2006). Ligado a este tema se menciona también el efecto que causaría en plantas nativas que morfológicamente no se adaptarían a esta abeja foránea (Goulson 2003, Hingston 2005); en algunos casos se producirían efectos negativos asociados a servicios de polinización.
A partir de la bibliografía y observaciones de campo registramos a B. terrestris forrajeando sobre 41 especies vegetales pertenecientes a 21 familias diferentes (Tabla 1), de las cuales 24 son plantas exóticas y 17 son especies nativas (Figura 3).
Disrupción de la polinización efectiva en plantas nativas
En algunos casos, B. terrestris podría causar la disrupción de la polinización efectiva en plantas nativas (Goulson 2003, Kenta et al. 2006, Traveset & Richardson 2006, Morales
2007, Madjidian et al. 2008). En observaciones de campo se detectó que las flores de Alonsoa meridionalis se caían luego de que B. terrestris había forrajeado sobre ellas; que en las plantas nativas Fuchsia lycioides y Tropaeolum tricolor (Figura 4) y en las exóticas Salvia leucantha y Lonicera japonica existe robo de néctar (orificio en la corola) sin que se realice ningún tipo de polinización (o ésta es muy pobre por parte del abejorro). El robo de néctar también puede afectar la frecuencia de visitas de las abejas nativas, probablemente polinizadoras efectivas de las plantas, siendo éste un efecto negativo indirecto sobre las plantas nativas (Ruz & Herrera 2001). Este comportamiento también se reporta para Embotrium coccineum y Vicia nigricans (Morales 2007).
En Japón se evaluó experimentalmente la efectividad de B. terrestris versus abejorros nativos sobre 7 plantas nativas, resultando que es menos eficiente en la polinización
de este tipo de plantas que los abejorros nativos; y que para la producción de semillas, en 5 especies ésta fue menor cuando eran visitadas exclusivamente por B. terrestris (Kenta et al. 2007).
Polinización de plantas exóticas
La polinización sobre plantas exóticas mediada por B. terrestris puede que produzca cambios en la producción de semillas, tanto positivos como negativos (Morales & Aizen 2002, Stout et al. 2002, Goulson 2003, Goulson 2005, Morales 2007). Estudios realizados en Tasmania por Stout et al. (2002) plantean el gran poder de invasión que ha tenido la planta exótica Lupinus arboreaus tras la introducción de B. terrestris a la isla. Algo similar plantea Hingston (2006) para Agapanthus praecox ssp. orientalis en la misma zona.
Cabe destacar el gran número de plantas exóticas e invasoras que pertenecen a la región paleártica (Arroyo et al. 2000); en concordancia con el origen primario de B. terrestris, en sus tierras de origen dichas plantas son polinizadas por este abejorro, siendo en algunos casos el polinizador más efectivo.
Al respecto, en nuestro país se ha observado una gran asociación con Galega officinalis, Teline monspessulana y Cirsium vulgare (Figura 5), plantas invasoras (Arroyo et al. 2000) de
origen paleártico en cuyo ambiente natural son visitadas por B. terrestris (Aytekin et al. 2002, Chapman et al. 2003).

Figura 5. Abejorro B. terrestris forrajeando sobre: A: Teline monspessulana; B: Cirsium vulgar; C: Galega officinalis.
Transmisión de patógenos
A pesar de todos los controles que se aplican sobre las especies que se importan, siempre existe la posibilidad de que ingresen patógenos que no pudieron ser fiscalizados. En nuestro país ocurrió con la abeja Megachile rotundata, que vino parasitada desde Estados Unidos con cuatro especies de microhymenopteros (Arretz et al. 1989, Ruz 2002); y
ocurrió con B. terrestris en otras partes del mundo, como Japón (Goka et al. 2001), donde algunos individuos ingresaron infectados con el ácaro Locustacarus buchneri, que se asilvestró y se volvió más virulento sobre las especies de abejorros nativos (Goka et al. 2006, Morales 2007).
B. terrestris es atacado además por el protozoo intestinal Crithidia bombi, que se ha documentado atacando varias especies de abejorros en Norteamérica (Morales
2007); igualmente, por el microsporidio Nosema bombi –endopatógeno de B. terrestris (Otti & Shmid-Hempel 2008)–, que puede atacar a otros congéneres nativos (Morales 2007, Otti & Shmid-Hempel 2008). Cabe señalar la dificultad en la detección de las 3 especies de parásitos mencionadas anteriormente, para las cuales se recomienda la disección de los especímenes con el objetivo de estar completamente seguros de su sanidad (Morales 2007).
Potencial hibridación con especies nativas
La potencial hibridación con especies emparentadas genéticamente se ha documentado para algunas plantas y mamíferos (Mack et al. 2000), pero en insectos este problema ha sido muy poco estudiado (Matsumura et al. 2004, Morales 2007). Las consecuencias de cópulas interespecíficas pueden llevar a una dilución de la identidad genética de las poblaciones de los organismos nativos, a generar híbridos no viables ya reducir la tasa de encuentros intraespecíficos, lo que puede mermar el tamaño de las poblaciones y también, potencialmente, producir una mayor mortalidad de hembras por estos apareamientos interespecíficos (Morales 2007, Kanbe et al. 2008). En Japón se han observado individuos de B. terrestris asilvestrados copulando con especies nativas de B. hypocrita (Matsamura et al. 2004, Kanbe et al. 2008), lo cual plantea la posibilidad de cópulas con otros congéneres.
CONCLUSIONES Y PREDICCIONES
Los datos acerca de la introducción y posterior asilvestramiento de B. terrestris en nuestro país son escasos, por lo que plantear que esta especie pueda causar problemas en
nuestros ambientes naturales puede ser aventurado. Sin embargo, como tampoco existe evidencia que permita descartar que este abejorro tenga un efecto negativo sobre los ecosistemas nativos, debería adoptarse como primera medida un principio precautorio: “culpable hasta que se pruebe su inocencia” (Mack et al. 2000); esto es, realizar estudios previos a la importación de insectos u otros organismos, evaluando a priori las posibles consecuencias que estas especies pudieran producir en nuestro país.
Proyectando los efectos que este abejorro exótico pudiera tener, quizás éstos no se limiten a lo ecológico sino que también se podrían transformar en problemas económicos
(Cane 2001, Ghazoul 2005, Kremen et al. 2004). Esto ocurrió con la introducción de la abeja africana A. mellifera scutellata Lepeletier en Brasil y su posterior invasión hacia el Caribe (Roubik 1978) y con el asilvestramiento de Vespula germanica (F.) en Chile (Magunacelaya et al. 1984), entre muchos otros casos emblemáticos (Estades 1998) que han reportado pérdidas monetarias cuantiosas.
Además, se hace muy necesario enfocar investigaciones hacia abejas nativas y su papel específico como polinizadoras tanto de vegetación nativa como de campos de cultivo, lo que podría ayudar a un mejor entendimiento de las introducciones de abejas y sus interacciones con las especies nativas, y al mantenimiento de ecosistemas menos perturbados.
Tabla 1. Especies de plantas sobre las cuales se ha registrado forrajeando a B. terrestris
| Familias | Especies | |
|---|---|---|
| Nativas | Exóticas | |
| Anacardiaceae | Lithraea caustica (Mol.) Hook. et Arn., Schinus latifolia (Gill. Ex Lindl.) Engler |
|
| Apiaceae | Eryngium paniculatum Cav. et Domb. ex Delar. | |
| Asteraceae | Carduus pycnocephalus L., Cirsium vulgare Savi, Cynara cardunculus L., Chrysanthemum sp., Centaurea solstitialis L. | |
| Bignoniaceae | Jacaranda mimosifolia D. Don | |
| Boraginaceae | Echium vulgare L., Borago officinalis L. | |
| Brassicaceae | Brassica campestris (L) | |
| Escalloniaceae | Escallonia pulverulenta (R et P) Pers. | |
| Fabaceae | Otholobium glandulosum L., Senna candolleana (Vogel) Irw. & Barn. | Galega officinalis L., Parkinsonia aculeata L., Teline monspessulana (L.) K. Koch |
| Fumariaceae | Fumaria capreolata L. | |
| Geraniaceae | Geranium sp. | |
| Lamiaceae | Lavandula sp., Mentha aquatica Ehrh, Salvia leucantha Cav. | |
| Myrtaceae | Eucalyptus globulus Labill | |
| Onagraceae | Fuchsia lycioides Andrews | |
| Poligonaceae | Poligonum persicaria L. | |
| Solanaceae | Schizanthus hookeri Gill. ex Graham | |
| Rosaceae | Quillaja saponaria Mol | Rubus ulmifolius Schott |
| Rhamnaceae | Colletia spinosissima Gmel, Retanilla trinervia Miers. | |
| Scrophulariaceae | Alonsoa meridionalis L. F., Mimulus luteus L. | Digitalis purpurea L., Verbascum virgatum Stokes |
| Tropaeolaceae | Tropaeolum azureum Bert. ex Colla, Tropaeolum tricolor Sweet | Lonicera japonica Thunb., Tropaeolum majus L. |
| Violaceae | Viola portalesia Gay | |
| Winteraceae | Drimys winteri J. R. et Forster | |
GLOSARIO
especialista = especie que incluye un reducido espectro de recursos en su dieta.
eusocial = fenómeno de la especialización reproductiva encontrada en algunas especies de insectos, caracterizado por una organización jerárquica dentro de una colonia, además de la presencia de individuos estériles subordinados.
generalista = especie que incluye un amplio espectro de recursos en su dieta.
microhymenoptero = grupo del orden Hymenoptera caracterizado por ser de pequeño tamaño y parasitoide de otros organismos.
microsporidio = tipo de hongo parásito intracelular de animales.
nicho = hipervolumen de los recursos (hábitat, alimento, etcétera) ocupados por un organismo.
paleártico = una de las ocho divisiones de la Tierra en función de zonas ecológicas. Incluye al continente europeo, la zona norte del Himalaya en el continente asiático, África septentrional, y el norte y centro de la península arábiga.
patógeno = capaz de causar una enfermedad a un receptor.
sobreposición = dos o más especies ocupando el mismo nicho.
BIBLIOGRAFÍA
- Abrahamovich A & N Díaz. 2002. Bumble bees of the neotropical region (Hymenoptera: Apidae). Biota Colombiana 3(2): 199-214.
- Aizen M. 2002. Habitat fragmentation, pollinator decline, and plant pollination, en Kevan P & VL Imperatriz-Fonseca (eds.), Pollinating bees. The conservation link between agriculture and nature, pp. 251-252. Ministry of Environment, Brasilia, 313 pp.
- Aizen M, C Morales & J Morales. 2008. Invasive mutualists erode native pollination webs. Plos Biology 6(2): e31.
- Arretz P & R Macfarlane. 1986. The introduction of Bombus ruderatus to Chile for red clover pollination. Bee World 67(1): 15-22.
- Arretz P, M Guerrero, L De Santis & L Lamborot. 1989. Presencia en Chile de Aprostocetus daira (Walker) (Hymenoptera: Eulophidae). Acta Entomológica Chilena 15: 275-276.
- Arroyo MTK, C Marticorena, O Matthei & L Cavieres. 2000. Plant invasions in Chile: present patterns and future predictions, en HA Mooney & R Hobbs (eds.), Invasive species in a changing world, pp. 385-421. Island Press, Nueva York, 457 pp.
- Aytekin A, N Çagatay & S Hazır. 2002. Floral choices, parasites and micro-organisms in natural populations of bumblebees (Apidae: Hymenoptera) in Ankara Province. Turkish
Journal of Zoology 26: 149-155. - Baer B & P Schmid-Hempel. 2003. Effects of selective episodes in the field on life history traits in the bumblebee Bombus terrestris. Oikos 101: 563-568.
- Biesmeijer JC, S Roberts, M Reemer, R Ohlemuller, M Edwards, T Peeters, A Schaffers, S Potts, R Kleukers, CD Thomas, J Settele & WE Kunin. 2006. Parallel declines in pollinators
and insect-pollinated plants in Britain and the Netherlands. Science 313: 286. - Buchmann S & G Nabhan. 1996. The pollination crisis. The Sciences 36(4): 10-13.
- Buttermore, RE. 1997. Observations of successful Bombus terrestris (L.) (Hymenoptera: Apidae) colonies in southern Tasmania. Australian Journal of Entomology 36: 251-254.
- Cane JH. 2001. Habitat fragmentation and native bees: A premature veredict?Conservation Ecology 5(1): 3.
- Chapman R, J Wang & A Bourke. 2003. Genetic analysis of spatial foraging patterns and resource sharing in bumble bee pollinators. Molecular Ecology 12(10): 2801-2808.
- Dafni A & A Shmida. 1996. The possible ecological implications of the invasion of Bombus terrestris (L.) (Apidae) at Mt Carmel, Israel, en Matheson A, SL Buchmann, C O’Toole, P Westrich & IH Williams (eds.), The conservation of bees, pp. 183-200. Academic Press, Londres, 254 pp.
- Dafni A. 2002. Fire, Bombus terrestris invasion and the threat to solitary bee diversity in mediterranean ecosystem, en Kevan P & VL Imperatriz-Fonseca (eds.), Pollinating bees. The conservation link between agriculture and nature, p. 297. Ministry of Environment, Brasilia, 313 pp.
- Estades C. 1998. Especie non grata: efectos ecológicos de las especies exóticas. Ciencia al Día 1(2): 1-12, noviembre 2008.<www.ciencia.cl/cienciaaldia/volumen1/numero2/ articulos/articulo6.html>
- Fried P. 1999. Evaluación de la polinización y cuaja en palto (Persea americana Mill.) mediante el uso de Bombus terrestris (Hymenoptera: Apidae) en la localidad de Quillota,
Quinta Región. Memoria de título. Pontificia Universidad Católica de Valparaíso, 94 pp. - Ghazoul J. 2005. Buzzines as usual? Questioning the global pollination crisis. Trends in Ecology and Evolution 20(7): 367-372.
- Gegear R & T Laverty. 1998. How many flower types can bublebees work at the same time? Canadian Journal of Zoology 76: 1358-1365.
- Goka K, K Okanabe, M Yoneda & S Niwa. 2001. Bumblebee commercialization will cause worldwide migration of parasitic mites. Molecular Ecology 10: 2095-2099.
- Goka K, K Okanabe & M Yoneda. 2006. Worldwide migration of parasitic mites as a result of bumblebee commercialization. Population Ecology 48: 285-291
- Goulson D, JC Stout & AR Kells. 2002. Do exotic bumblebees and honeybees compete with native flower-visiting insects in Tasmania? Journal of Insect Conservation 6: 179-189.
- Goulson D. 2003. Effects of introduced bees on native ecosystems. Annual Review of Ecology, Evolution, and Systematics 34: 1-26.
- Goulson D & ME Hanley. 2004. Distribution and forage use of exotic bumblebees in South Island, New Zealand. New Zealand Journal of Ecology 28(2): 225-232.
- Goulson D. 2005. Risks of increased weed problems associated with introduction of non-native bee species. Journal of Food, Agriculture and Environment 3(2):11-13.
- Hingston A & P McQuillan. 1999. Displacement of Tasmanian native megachilid bees by the recently introduced bumblebee Bombus terrestris (Linnaeus, 1758) (Hymenoptera: Apidae). Australian Journal of Zoology 47(1):59-65.
- Hingston A, J Marsden-Smedley, D Driscoll, S Corbett, J Fenton, R Anderson, C Plowman, F Mowling, M Jenkin, K Matsui, K Bonham, M Ilowski, P Macquillan, B Yaxley, T Reid, D
Storey, L Poole, S Mallick, N Fitzgerald, J Kirkpatrick, J Febey, A Harwood, K Michaels, M Russell, P Black, L Emmerson, M Visoiu, J Morgan, S Breen, S Gates, M Bantich & J Desmarchelier. 2002. Extent of invasion of Tasmanian native vegetation by exotic bumblebee Bombus terrestris (Apoidea: Apidae). Austral Ecology 27: 162-167. - Hingston A. 2005. Does the introduced bumblebee, Bombus terrestris (Apidae), prefer flowers of introduced or native plants in Australia? Australian Journal of Zoology 53: 29-34.
- Hingston A. 2006. Is the introduced Bumblebee (Bombus terrestris) assisting the naturalization of Agapanthus praecox ssp. orientalis in Tasmania? Ecological Management & Restoration 7(3): 236-238.
- Inari N, T Nagamitsu, T Kenta, K Goka & T Hiura. 2005. Spatial and temporal pattern of introduced Bombus terrestris abundance in Hokkaido, Japan, and its potencial impact
on native bumblebees. Population Ecology 47: 77-82. - Ings T, J Schikora & L Chittka. 2005. Bumblebees, humble pollinators or assiduous invaders? A population comparison of foraging performance in Bombus terrestris. Oecologia 144: 508-516.
- Ings T, N Ward & L Chittka. 2006. Can commercially imported bumble bees out-compete their native conespecifics? Journal of Applied Ecology 43: 940-948.
- Inoue M, J Yokoyama, I Washitani. 2008. Displacement of Japanese native bumblebees by the recently introduced Bombus terrestris (L.) (Hymenoptera: Apidae). Journal of Insect Conservation 12:135-146.
- Kanbe Y, I Okada, M Yoneda, K Goka & K Tsuchida. 2008. Interspecific mating of the introduced bumblebee Bombus terrestris and the native Japanese bumblebee Bombus
hypocrita sapporoensis results in inviable hybrids. Naturwissenschaften 95: 1003-1008. - Kenta T, N Inari, T Nagamitsu, K Goka & T Hiura. 2007. Commercialized European bumblebee can cause pollination disturbance: An experiment on seven native plant species in Japan. Biological Conservation 134: 298-309.
- Kremen C, N Williams & R Thorp. 2004. Crop pollination from native bees at risk from agricultural intensification. Proceedings of the National Academy of Science, 99:
16812-16816. - Larson M & M Frazén. 2007. Critical resource levels of pollen for the declining bee Andrena hattorfiana (Hymenoptera, Andrenidae). Biological Conservation 134: 405-414.
- Laverty TM. 1980. The flower-visiting behaviour of bumble bees: floral complexity and learning. Canadian Journal of Zoology 58: 1324-1335.
- Mack R, D Simberloff, W Lonsdale, H Evans, M Clout & F Bazzaz. 2000. Biotic invasions: causes, epidemiology, global consequences, and control. Ecological Applications 10: 689-710.
- Madjidian J, C Morales & H Smith. 2008. Displacement of a native by an alien bumblebee: lower pollinator efficiency overcome by overwhelmingly higher visitation frequency. Oecologia 156(4): 835-845.
- Magunacelaya J, E Chiappa & P Ojeda. 1984. Biología, problemas y control de la avispa chaqueta amarilla. Programa de control de plagas y enfermedades forestales. Corporación Nacional Forestal, V Región. 19 pp.
- Matsumura C, J Yokohama & I Washitani. 2004. Invasion status and potential ecological impacts of an invasive alien bumblebee, Bombus terrestris L. (Hymenoptera: Apidae)
naturalized in southern Hokkaido, Japan. Global Environmental Research 8(1): 51-66. - Moller H. 1996. Lessons for invasion theory from social insects. Biological Conservation 78: 125-142.
- Morales C & MA Aizen. 2002. Does invasion of exotic plants promote invasion of exotic flower visitors? A case study from the temperate forests of the southern Andes. Biological
invasions 4: 87-100. - Morales C & MA Aizen. 2004. Potential displacement of the native bumblebee Bombus dahlbomii by the invasive Bombus ruderatus in NW Patagonia, en K Hartfelder y
D de Jong (eds.), Proceedings of the 8th International Conference on Tropical Bees and VI Encontro sobre Abelhas, pp 70-76. International Bee Research Association. 661 pp. - Morales C. 2007. Introducción de abejorros (Bombus) no nativos: causas, consecuencias ecológicas y perspectivas. Ecología Austral 17: 51-65.
- Olavarria A. 2003. Evaluación del abejorro Bombus terrestris y nativo Bombus dahlbomii, reproducidos en laboratorio como polinizadores de flores de arándano y pimiento. Avance Agrícola 117: 18-20.
- O’Toole C. 1994. Who cares for solitary bees?, en A Matheson (ed.), Forage for bees in an agricultural landscape, pp 47-56. International Bee Research Association, Cardiff, Reino Unido, 75 pp.
- Otti O & P Shimid-Hempel. 2008. A field experiment on the effect of Nosema bombi in colonies of bumblebee Bombus terrestris. Ecological Entomology 33, 577-582.
- Rebolledo R, H Martínez, R Palma, A Aguilera & C Klein. 2004. Actividad de visita de Bombus dahlbomi (Guerin) y Bombus ruderatus (F.) sobre trébol rosado (Trifolium pratense L.) en la IX Región de La Araucanía, Chile. Agricultura Técnica 64(3): 245-250.
- Roig-Alsina A & MA Aizen. 1996. Bombus ruderatus, una nueva especie de Bombus para la Argentina (Hymenoptera: Apidae). Physis, 51: 120-121.
- Roubik D. 1978. Competitive interactions between neotropical pollinators and africanized honey bees. Science 201:1030-1032.
- Roubik D. 2001. Ups and downs in pollinator populations: when is there a decline?Conservation Ecology 5(1): 2.
- Ruz L & R Herrera. 2001. Preliminary observations on foraging activities of Bombus dalhbomii and Bombus terrestris (Hymenoptera: Apidae) on native and non-native vegetation in Chile. International Society for Horticultural Science (ISHS), Acta Horticulturae 561: 165-169.
- Ruz L. 2002. Bee pollinators introduced to Chile: A review, en Kevan P & VL Imperatriz-Fonseca (eds.), Pollinating bees. The conservation link between agriculture and nature, pp 155-167. Ministry of Environment, Brasilia, 313 pp.
- Ruz L & F Vivallo. 2005. Las abejas de la cordillera de Nahuelbuta, en C Smith-Ramírez, JJ Armesto y C Valdovinos (eds.), Historia, biodiversidad y ecología de los bosques costeros de Chile, pp. 369-388. Editorial Universitaria, Santiago, 710 pp.
- Stout JC, AR Kells & D Goulson. 2002. Pollination of a sleeper weed, Lupinus arboreus, by introduced bumblebees in Tasmania. Biological Conservation 106: 425-434.
- Thorp R. 1996. Resource overlap among native and introduced bees in California, en Matheson A, S Buchmann, C O’Toole, P Westrich & IH Williams (eds.), The conservation of bees, pp. 143-151. Academic Press, Londres, 254 pp.
- Toro H. 1986. Problemas en la introducción y desarrollo de la apicultura en zonas áridas o semiáridas de Chile. Boletín Sociedad de Biología de Concepción 57: 81-88.
- Torreta J, D Medan & A Abrahamovich. 2006. First record of the invasive bumblebee Bombus terrestris (L.) (Hymenoptera: Apidae) in Argentina. Transactions of the American
Entomological Society 132(3): 285-216. - Traveset A & D Richarson. 2006. Biological invasions as disruptor of plant reproductive mutualisms. Trends in Ecology and Evolution 21: 208-216.
- Tylianakis J. 2008.Understanding the web of life: the birds, the bees, and sex with aliens. Plos Biology 6(2): e47.
- Walter-Hellwig K & R Frankl. 2000. Foraging habitats and foraging distances of bumblebees, Bombus spp. (Hymenoptera: Apidae), in an agricultural landscape. Journal of Applied Entomology 124: 229-306.
- Winter K, L Adams, R Thorp, D Inouye, L Day, J Ascher & S Buchmann. 2006. Importation of non-native Bumble bees into North America: potential consequences of using Bombus terrestris and other non-native bumblebees for greenhouse crop pollination in Canada, Mexico, and the United States. White Paper of the North American Pollinator Protection Campaign. 33 pp.