A mí siempre me resultó difícil tarea la de llegar a comprender exactamente lo que eran los complejos, algo totalmente diferente a cualquier tipo de enlace que haya visto hasta el momento. Es por esto por lo que me he decidido a hablar en mi blog sobre complejos, pero no sobre cualquier tipo de complejos, sólo aquellos que guarden algún tipo de relación con nuestro día a día. Para comenzar debemos plantearnos aquellas sustancias y aquellos metales que tienen esta capacidad de acomplejar.
-Metales: cualquier metal normalmente de transición que pueda actuar como “aceptor” de electrones. Por ej. el cobre, el cobalto o la plata.
Recordamos la configuración electrónica por diagrama Moeller para el cobre.
Cu(29 e.): 1s2 2s2 2p6 3s2 3p6 4s2 3d9
El nivel 3d que va antes del 4s está vacío, por tanto puede aceptar electrones.
Argón: 1s2 2s2 2p6 3s2 3p6
Según principio construcción de Aufbau:
| 4s | 3d | 3d | 3d | 3d | 3d | |
| Argón |
Recordamos que: en cada orbital s caben 2 electrones, en cada orbital p caben 6 y en el d caben hasta 10.
También es importante recordar que ![]()
![]() son los números de spin de los electrones.
son los números de spin de los electrones.
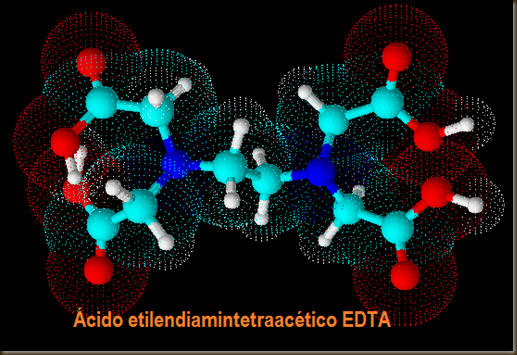
-Agentes complejantes y demás: cualquier sustancia que contenga en su fórmula electrones no enlazantes y pueda actuar como “dador” de electrones. Por ej. el EDTA una sustancia muy utilizada en química para determinar la dureza de un agua.
Los átomos de nitrógeno en azul oscuro tienen gran capacidad de acomplejar, dados sus dos electrones no enlazantes.
 Volvamos a la utilidad y es que esto es justo lo que pretendía al hacer este post. La utilidad para la química de los complejos puede demostrarse tan solo bebiendo agua, cualquier agua mineral contiene unos parámetros de mineralización que constan en cada botella a modo de “análisis químico”. Pues bien el Calcio y el Magnesio pueden analizar o bien con técnicas instrumentales como la fotometría de llama o bien con técnicas clásicas usando EDTA este agente complejante del que hemos hablado arriba.
Volvamos a la utilidad y es que esto es justo lo que pretendía al hacer este post. La utilidad para la química de los complejos puede demostrarse tan solo bebiendo agua, cualquier agua mineral contiene unos parámetros de mineralización que constan en cada botella a modo de “análisis químico”. Pues bien el Calcio y el Magnesio pueden analizar o bien con técnicas instrumentales como la fotometría de llama o bien con técnicas clásicas usando EDTA este agente complejante del que hemos hablado arriba.
El EDTA tiene la capacidad de ser un buen agente complejante, por tanto nos valemos de un indicador como la Murexida para poder determinar el punto final cuando todo el calcio haya pasado del agua a las moléculas del EDTA.
También existe una técnica clásica de determinación de cloruros llamada Volhard, en la que el punto final lo da el hierro(III) al formar complejo con el tiocianato.
Fe+3 + SCN-1 >> [Fe(SCN)]+2
O ¿quién no ha comprado nunca unos zapatos y ha encontrado en su interior unas bolsitas con una calavera? Pues bien estas bolsitas contienen silica gel SiO2 poroso que tiene la capacidad de retener el agua absorbiendo la humedad. La calavera la incluyen porque estas bolitas generalmente coloreadas contiene sales de cobalto(generalmente CoCl2) que en su forma anhidra(sin agua) son de color azul. Al agregar agua, una vez la silica gel ya está saturada cambia a color rosado. Estos cambios de color se deben a las moléculas de hidratación que se adhieren al cobalto.
Co+2 + 6H2O >> [Co(H2O)6]+2
Estas bolitas al secarse al ponerlas en una estufa su agua retenida se evapora pudiéndose volver a usar.
Un poco de experimentación:
Os dejo con un experimento simple, necesitamos una sal de cobre, agua y amoníaco.
Cu+2 + 4NH3 >> [Cu(NH3)4]+2
La sal de cobre una vez disuelta en agua toma un color azulado debido a que transmite el color azul de la luz. Al añadir amoníaco observamos que el color se vuelve más eléctrico y oscuro se ha formado por tanto una molécula diferente en la que los electrones no enlazantes del nitrógeno se coordinan con el cobre para formar este complejo tan característico.
Si os ha gustado este artículo o tenéis alguna duda, dejarme un comentario, contestaré lo antes posible ![]()