En uno de esos avances que hace tan solo unos años nos parecería el comienzo de una novela de ciencia ficción, un grupo de investigadores ha logrado desarrollar y cultivar miniórganos (organoides) a partir de células eliminadas por los fetos en el útero. El asombroso logro promete arrojar luz sobre el desarrollo humano durante la última etapa del embarazo. El trabajo acaba de publicarse en Nature.
Tal y como cuentan en el estudio, estos miniórganos u organoides son haces de células en 3D que imitan la estructura, función y complejidad biológica de los órganos, aunque en una escala mucho más pequeña y simple. Por lo general, se crean a partir de células extraídas de biopsias que se reprograman en células madre. De hecho, hasta ahora se han cultivado organoides de muchos tipos de tejidos, incluidos el cerebro, el corazón e incluso los testículos, y normalmente se utilizan para modelar enfermedades y probar medicamentos.
Sin embargo, los trabajos anteriores se han limitado a muestras obtenidas de la interrupción de embarazos, de ahí el hito de este nuevo logro al ser la primera vez que se cultivan organoides directamente a partir de células extraídas de embarazos en curso.
El trabajo partió de ideas ya conocidas por la ciencia. Por ejemplo, se sabe que el líquido amniótico contiene células fetales. Eso es lo que permite a los médicos diagnosticar enfermedades como el síndrome de Down y la anemia falciforme antes del nacimiento mediante la amniocentesis, en la que se utiliza una aguja para tomar una muestra del líquido.
La gran mayoría de estas células, el 95% o incluso más, son células muertas desprendidas por el feto. En este caso, los investigadores se centraron en la fracción mucho más pequeña de células vivas en el líquido amniótico.
Para ello y como decimos, utilizaron el líquido amniótico como fuente de células vivas, pudiendo así evitar algunos de los problemas que han frustrado esfuerzos anteriores y estudiar el tejido fetal en etapas posteriores de desarrollo. Un esfuerzo que involucró una técnica con células de pulmón, riñón e intestino extraídas del líquido amniótico recolectado de 12 embarazos entre las semanas 16 y 34 de gestación.
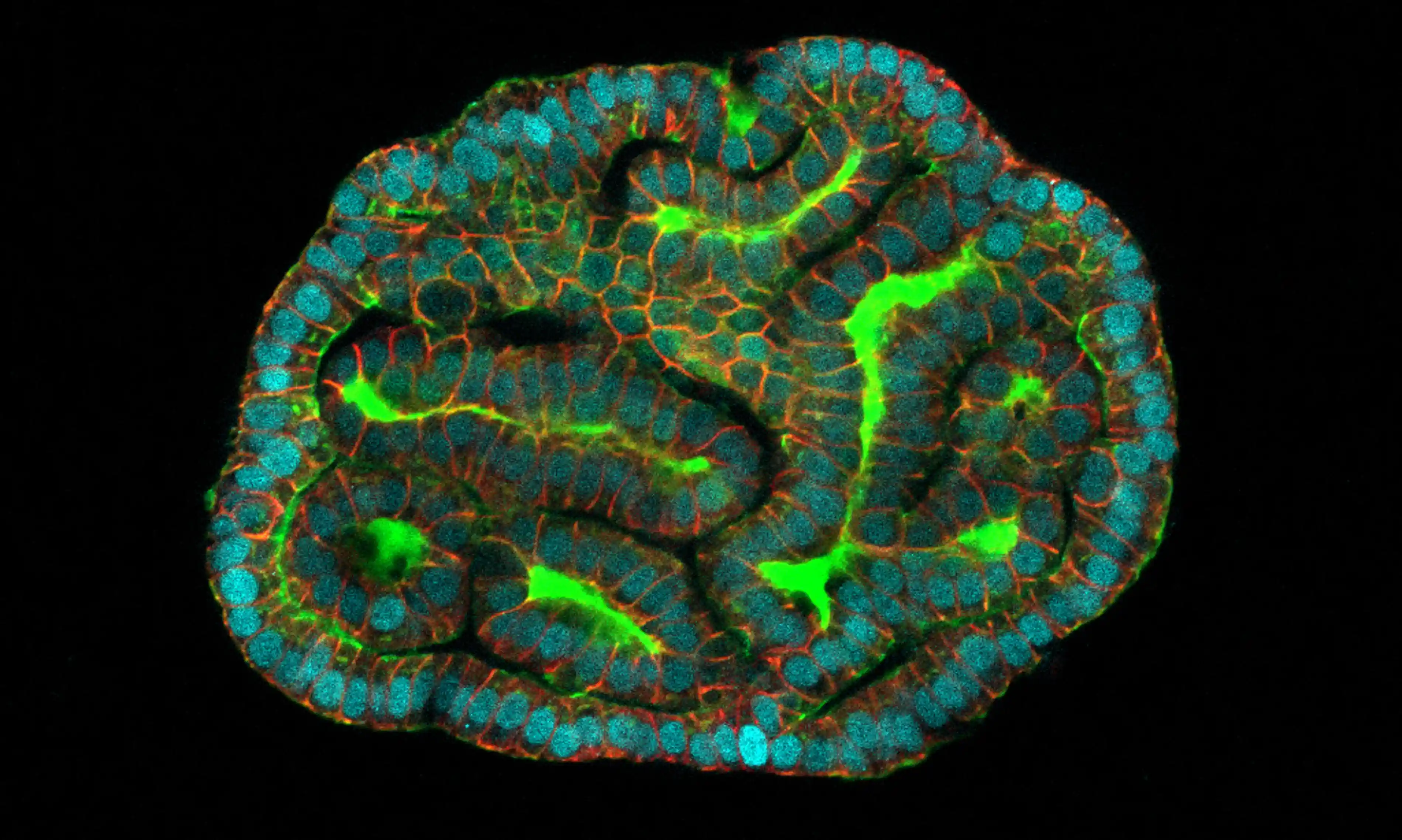
Luego, dichas células se cultivaron en una placa en el laboratorio y se “convencieron” para que formaran haces de tejido. Cuentan que cada miniórgano era capaz de expresar los genes y proteínas del órgano del que se originaba.
En la publicación detallan que trabajaron para determinar qué tipos de células había, mapeando sus identidades y luego usando secuenciación unicelular para evaluar dónde se originaron. A continuación, se colocó esos tres tipos de células progenitoras de las que hablábamos (riñón, pulmón e intestino delgado) en un cultivo 3D para ver si formarían organoides.
¿Qué ocurrió? Que funcionó. Los organoides crecieron y desarrollaron características del tejido del que procedían las células. En cuestión de semanas, los organoides pulmonares, por ejemplo, tenían estructuras palpitantes parecidas a pelos llamadas cilios, como las que se encuentran dentro del pulmón.

Según Oren Pleniceanu, biólogo de células madre y director del Centro de Investigación Renal del Centro Médico Sheba y de la Universidad de Tel-Aviv:
Todo el concepto es realmente innovador. Esta capacidad de obtener células fetales del líquido amniótico es como una biopsia gratuita. Con todo, todavía hay margen de mejora a la hora de describir las células presentes. No es tan fácil definir qué células son.
Para ver si sus organoides pulmonares podrían proporcionar información relevante sobre defectos de nacimiento congénito, el equipo recolectó células de fetos con una rara condición llamada hernia diafragmática congénita (CDH). Estos fetos tienen un espacio en el diafragma que permite que los órganos del abdomen empujen hacia la cavidad torácica y compriman los pulmones. “Si el pulmón se comprime, no se desarrolla como debería. Así que sólo el 70% de estos fetos sobrevivirá“, explican.
Luego, compararon organoides cultivados a partir de fetos CDH con organoides cultivados a partir de fetos sanos. Aunque a primera vista ambos organoides tenían el mismo aspecto, cuando los obligaron a diferenciar para imitar la parte del pulmón más cercana a la tráquea, o las porciones más profundas del pulmón, vieron algunas diferencias sorprendentes.
En esencia, tanto los organoides CDH como los sanos desarrollaron cilios, pero el patrón era diferente en los CDH y tuvieron más dificultades para diferenciarse. Además, los CDH también produjeron menos surfactante, una sustancia que ayuda a que los alvéolos de los pulmones funcionen correctamente.
Los CDH se pueden tratar gracias a la colocación de una especie de globo en la tráquea del feto para obligar a los pulmones a empujar hacia atrás contra los órganos invasores. Partiendo de ello, los investigadores compararon los organoides pulmonares cultivados a partir de células extraídas del líquido amniótico antes y después del procedimiento con balón, descubrieron que los organoides tratados crecieron más como organoides pulmonares normales y su expresión genética sugería que estaban más desarrollados.
Alucinante, ya que como cuentan, la colocación del balón requiere cirugía fetal y normalmente no se tiene una buena forma de determinar qué fetos podrían beneficiarse y cuáles no. Sin embargo, los organoides personalizados sí podrían ayudarlos a determinar lo subdesarrollados que están los pulmones para que puedan tomar una decisión más detallada. No solo eso. Para aquellos fetos que se someten al procedimiento, los organoides podrían brindar a los médicos información sobre si funcionó.
Dicho de otra forma, sus hallazgos podrían ayudar a estudiar y tratar varios defectos congénitos graves, que afectan a entre el 3 y el 6 por ciento de los bebés en todo el mundo, además, sugieren que los organoides, creados meses antes de que nazca un bebé, podrían usarse en intervenciones de medicina personalizada, para ayudar a diagnosticar y tratar afecciones congénitas antes del nacimiento.




Deja un comentario