8.3: Grupo 1, Los Metales Alcalinos
- Page ID
- 81442
Los Metales Alcalis
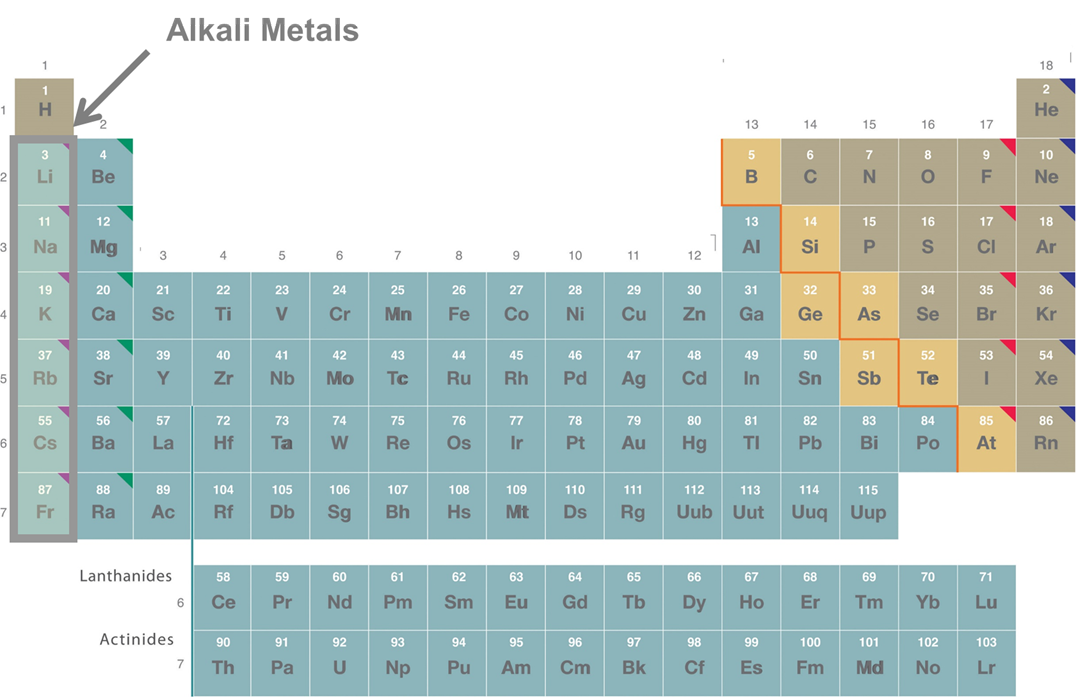
Los metales alcalinos comprenden los elementos litio a través de Francium en el grupo 1 de la tabla periódica, como se muestra en la Figura\(\sf{\PageIndex{1}}\).
Los metales alcalinos son potentes reductores y por lo tanto no existen como el metal libre en el ambiente relativamente oxidante en la superficie de la Tierra. Como resultado se encuentran comúnmente como los cationes +1 en una variedad de minerales como la sal de roca (halita, NaCl) y Natron (Na 2 CO 3 ·10H 2 O).
Debido a que se presentan como minerales, los metales alcalinos libres se preparan por reducción electrolítica de sus cationes +1. Por ejemplo, en el proceso Downs para hacer sodio el NaCl se electroliza a Na (l) y Cl 2 (g).
\[\sf{2~NaCl(l)~~\rightarrow~~2~Na(l)~~+~~Cl_2(g)} \nonumber \]
Para que este proceso ocurra rápidamente debe ocurrir el transporte de cationes al cátodo y aniones al ánodo. Para permitir esto se funde la sal a electrolizar. 1 Además, dado que el metal alcalino es reactivo, la electrólisis debe realizarse en una celda especializada que permita la separación del metal tanto de la sal como de cualquier producto de oxidación formado en el ánodo. Por ejemplo, para evitar la reacción explosiva exotérmica entre el gas cloro y los productos de sodio fundido en el proceso Down, se emplean celdas Downs especializadas en las que el cátodo y el ánodo se separan cuidadosamente. Una forma típica de celda Downs se representa en la Figura\(\sf{\PageIndex{2}}\).
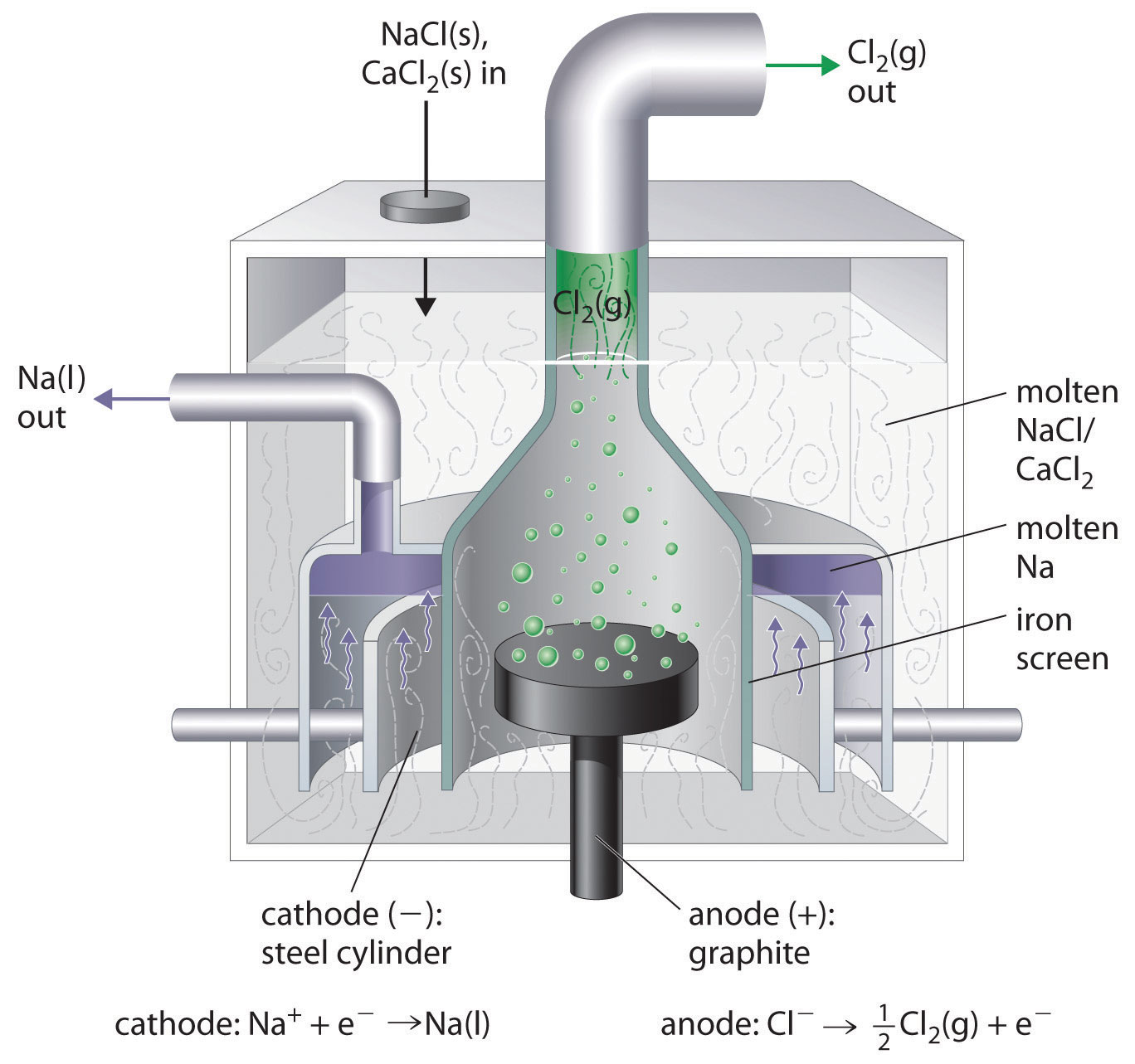
Como puede verse en la celda de la Figura\(\sf{\PageIndex{2}}\), el gas cloro formado en el ánodo y el metal sodio formado en el cátodo se mantienen separados permitiendo que el gas Cl 2 burbujee fuera de la celda y que el metal de sodio se acuda por encima del cátodo (ya que la densidad del sodio es menor que la del NaCl fundido flota hasta la parte superior del cloruro de sodio fundido).
Los metales alcalinos también se pueden formar por reducción química. Por ejemplo, el potasio se puede preparar reduciendo las sales de potasio con Na, carburo o carbono de acuerdo con las siguientes reacciones.
\[\sf{KCl~~+~~Na~~\rightarrow~~K~~+~~NaCl} \nonumber \]
\[\sf{2~KX~~+~~CaC_2~~\rightarrow~~2~K~~+~~CaX_2~~+~~C~~(X~=~F,~Cl} \nonumber \]
\[\sf{K_2CO_3~~+~~2~C~~\rightarrow~~2~K~~+~~3~CO} \nonumber \]
Una vez formados, los metales alcalinos se almacenan bajo una atmósfera inerte o bajo aceite hidrocarbonado para evitar su reoxidación.
Propiedades
En forma metálica los metales alcalinos poseen una estructura cúbica centrada en el cuerpo (BCC) y son sólidos plateados, como se muestra en la Figura\(\sf{\PageIndex{3}}\).

Al igual que otros metales, los metales alcalinos son buenos conductores de calor y electricidad, maleables y dúctiles. Sin embargo, en comparación con otros metales, los metales alcalinos tienen un pequeño número de electrones de valencia y cargas nucleares efectivas relativamente bajas. Como resultado, los enlaces metálicos que mantienen unidos los metales alcalinos sólidos y líquidos son más débiles que los de otros metales y se funden y hierven a temperaturas más bajas, como lo ilustran los puntos de fusión y ebullición enumerados en la Tabla\(\sf{\PageIndex{1}}\). Además, como se puede observar a partir de los datos de la Tabla\(\sf{\PageIndex{1}}\) tanto los puntos de fusión como de ebullición disminuyen por el grupo del metal alcalino. Esta disminución en los puntos de fusión y ebullición refleja una disminución en la fuerza de unión metálica a medida que el tamaño atómico (y en consecuencia la distancia promedio electrón-núcleo) aumenta en el grupo.
Mesa\(\sf{\PageIndex{1}}\). Puntos de fusión y ebullición de los metales alcalinos y sustancias de referencia seleccionadas. 3
| Sustancia | Punto de fusión (\(^{\circ}\)C) | Punto de ebullición (\(^{\circ}\)C) |
| Metal alcalino | ||
| Litio, Li | 181 | 1347 |
| Sodio, Na | 98 | 883 |
| Potasio, K | 64 | 774 |
| Rubidio, Rb | 39 | 688 |
| Cesio, Cs | 28 | 678 |
| Francium | 27 | 677 |
| Metal no alcalino | ||
| Magnesio | 649 | 1090 |
| Bario | 727 | 1845 |
| Titanio | 1660 | 3287 |
| Hierro, Fe | 1538 | 2861 |
| Cobre | 1083 | 2567 |
| Agua | 0 | 100 |
| benceno | 6 | 80 |
La unión metálica de resistencia relativamente baja en los metales alcalinos también se refleja en su suavidad. Los metales son tan suaves que me presionan en láminas y cortan una espátula de laboratorio ordinaria. De hecho, las espátulas se utilizan comúnmente para cortar porciones de metal de tamaño apropiado cuando se usan en el laboratorio.
Las propiedades atómicas de los metales alcalinos reflejan la energía relativamente alta y el gran tamaño de sus orbitales de valencia n s. En consecuencia poseen radios atómicos más grandes y energías de ionización menores que la mayoría de los metales, como puede verse a partir de los datos que se muestran en la Tabla\(\sf{\PageIndex{2}}\).
Mesa\(\sf{\PageIndex{2}}\). Propiedades atómicas seleccionadas de los metales alcalinos y compuestos de referencia seleccionados. 3,4
| Sustancia |
Radio atómico (Angstroms) |
Energía de ionización (KJ/mol) |
Electronegatividad Pauling |
| Metal alcalino | |||
| Litio, Li | 1.45 | 513 | 0.98 |
| Sodio, Na | 1.80 | 496 | 0.93 |
| Potasio, K | 2.20 | 419 | 0.82 |
| Rubidio, Rb | 2.35 | 403 | 0.82 |
| Cesio, Cs | 2.60 | 376 | 0.79 |
| Francium. Fr | no determinado | 400 | 0.7 |
| Metal no alcalino | |||
| Magnesio, Mg | 1.50 | 738 | 1.31 |
| Bario, Ba | 2.15 | 503 | 0.89 |
| Titanio, Ti | 1.40 | 658 | 1.54 |
| Hierro, Fe | 1.40 | 759 | 1.83 |
| Cobre, Cu | 1.35 | 745 | 1.90 |
| Boro, B | 0.85 | 801 | 2.04 |
| Nitrógeno, N | 0.65 | 1402 | 3.04 |
Como se explicará en la siguiente sección, las pequeñas energías de ionización de los metales alcalinos se encuentra entre los factores que contribuye a su extrema reactividad.
Referencias
1. El mineral a electrolizar debe ser capaz de fundirse a temperaturas adecuadamente bajas, ya sea por sí solo o cuando se mezcla con una sal electrolíticamente inerte para disminuir su punto de fusión.
2. Créditos de imagen de metales alcalinos: (a) Li: Por Tomihahndorf en Wikipedia alemana - Transferido de de.Wikipedia a Commons., Dominio Público, commons.wikimedia.org/w/inde...? curid=1744000; (b) Na: El cargador original fue Dnn87 en Wikipedia en inglés./CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0); (c) K: Autor desconocido/CC BY (https://creativecommons.org/licenses/by/1.0); (d) Rb: Dnn87/CC BY ( https://creativecommons.org/licenses/by/3.0); y (e) Cs: Dnn87 Correo electrónico de contacto: DNN87YAHOO.dk/CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)
3. Todos los datos de propiedades físicas y atómicas para los elementos excepto los radios atómicos y los puntos de ebullición y fusión de Ba y Fe se calculan a partir de datos en Emsley, J. Los elementos 2a ed. Oxford University Press, 1991. Los puntos de transición de fase para Ba y Fe fueron tomados de https://www.rsc.org/periodic-table/element/56/barium y deben tomarse como tentativos.
4. Los radios atómicos son los radios empíricos determinados por John C. Slater según lo reportado en Slater, J. C. J. Chem. Phys. 1964, 41, 3199-3204.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

