19: Acidificación
- Page ID
- 82553
Objetivos de aprendizaje
Después de completar este capítulo, usted será capaz de:
- Describir los ingredientes químicos más importantes de la precipitación y explicar cuáles pueden causar el desarrollo de acidez.
- Describir los patrones espaciales de precipitación ácida en América del Norte e identificar los factores que influyen en esta distribución.
- Explicar la diferencia entre la deposición húmeda y seca de sustancias acidificantes y cómo varían sus tasas.
- Describir cómo se afecta la química del agua a medida que la precipitación interactúa con la vegetación y el suelo, y explicar las implicaciones para las aguas superficiales.
- Identificar factores que hacen que las aguas dulces sean vulnerables a la acidificación.
- Describir los efectos de la acidificación en organismos de agua dulce.
- Discutir los roles del encalado y la fertilización en la recuperación de lagos acidificados.
- Explicar la importancia de reducir las emisiones de gases de azufre y nitrógeno para mitigar la acidificación de las aguas superficiales.
Introducción
La acidificación es un proceso que se caracteriza por aumentar las concentraciones de iones hidrógeno (H +) en el suelo o el agua. Puede provocar que los metales y sus compuestos se ionicen, produciendo iones (como Al 3+) en concentraciones lo suficientemente altas como para ser tóxicos para plantas, animales y microorganismos. En consecuencia, el aumento de la acidificación suele interpretarse como una degradación de la calidad ambiental. La acidificación es causada por muchas influencias, tanto naturales como antropogénicas, pero los problemas más extendidos están asociados con un fenómeno comúnmente conocido como lluvia ácida.
La lluvia ácida ha sido un problema importante en partes de América del Norte desde al menos la década de 1950, pero no se convirtió en un tema de alto perfil hasta principios de la década de 1970. Esta atención bastante repentina resultó del descubrimiento de que la lluvia ácida era un problema generalizado en Europa Occidental, y la constatación de que las mismas condiciones probablemente ocurrieron en América del Norte. Esta conciencia estimuló la investigación en Canadá y Estados Unidos, lo que demostró que la lluvia ácida estaba provocando una acidificación generalizada de lagos y arroyos, y posiblemente del suelo. La acidificación de los ecosistemas acuáticos resultó en importantes daños ecológicos, incluyendo la pérdida de muchas poblaciones de peces. Los edificios y otros materiales también estaban siendo dañados porque la acidez erosiona metales, pintura y algunos tipos de piedra de extracción.
Estrictamente hablando, el término “lluvia ácida” se refiere únicamente a las precipitaciones ácidas, que junto con las nevadas dan cuenta de la deposición húmeda. Sin embargo, los productos químicos acidificantes también se depositan de la atmósfera cuando no llueve ni nieva, a través de la deposición seca de ciertos gases y partículas. Una frase adecuada para definir este complejo de procesos es “la deposición de sustancias acidificantes de la atmósfera”, o más simplemente, la deposición acidificante. En este capítulo se examinan las causas naturales y antropogénicas de la acidificación de los ecosistemas. Nos enfocamos en las cualidades químicas de la precipitación ácida y la deposición seca, sus efectos sobre los ecosistemas terrestres y acuáticos, y cómo se puede evitar o mitigar la acidificación.
En Detalle 19.1: Ácidos y Bases
Un ácido se define como una sustancia que dona protones (iones hidrógeno, H +) durante una reacción química. Una solución acuosa es ácida si su concentración de H + es superior a 1 × 10 -7 moles por litro. En contraste, una base (álcali) dona iones hidroxilo (OH—) en reacciones químicas. Una solución es básica si su concentración de OH — excede de 1 × 10 -7 mol/L. (Un mol es una unidad fundamental que mide la cantidad de una sustancia y es igual a 6.02 × 10 23 moléculas, átomos o iones. Este número se conoce como constante de Avogadro y se deriva del número de átomos de carbono contenidos en 12 g (1 mol) de carbono-12.)
Los ácidos y las bases reaccionan juntos para formar agua y una sal neutra. Si están presentes números iguales de moles de cada uno, la solución tiene tanto acidez cero como alcalinidad cero —las concentraciones de H + y OH — son ambas exactamente de 1 × 10 -7 mol/L, se dice que dicha solución es neutra.
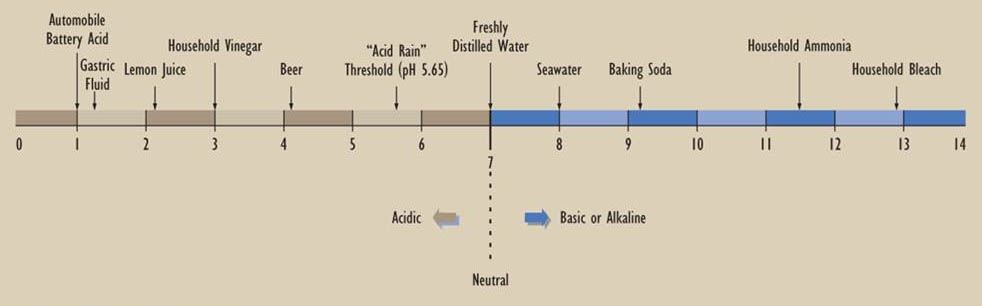
Debido a que se encuentran rangos extremadamente amplios de concentraciones de H + y OH — en la naturaleza y en los laboratorios, la acidez se mide en unidades logarítmicas, a las que se hace referencia como pH (una abreviatura de “potencial de hidrógeno”). pH se define como —log 10 H +], o el logaritmo negativo a base 10 de la concentración acuosa de ión hidrógeno, expresado en unidades de moles por litro. Las soluciones ácidas tienen un pH menor a 7.0, mientras que las soluciones alcalinas tienen un pH mayor a 7.0. Tenga en cuenta que una diferencia de una unidad en el pH implica una diferencia de 10 veces en la concentración de iones hidrógeno o hidroxilo. La escala que se ilustra a continuación muestra el pH de algunas sustancias comúnmente encontradas.
Química de la precipitación
Los científicos han adoptado una definición funcional de precipitación ácida como tener un pH inferior a 5.65. Este fue elegido como el punto de corte porque a pH 5.65, una solución acuosa de ácido carbónico (H 2 CO 3) está en equilibrio con CO 2 atmosférico, de la siguiente manera:
\[\ce{CO2 + H2O <=> H2CO3 <=> H^{+} + HCO3^{-} <=>⇌ 2H^{+} + CO3^{2-}}\]
Esta definición asume que la precipitación “no ácida” es esencialmente agua destilada, en la que la acidez está determinada únicamente por la concentración atmosférica de CO 2 y la cantidad de ácido carbónico que posteriormente se desarrolla. Es por ello que el umbral por debajo del cual la precipitación se considera “ácida” se establece en el pH ligeramente ácido de 5.65, más que al estricto pH de acidez cero de 7.0 (ver En Detalle 19.1).
Sin embargo, es demasiado simplista considerar que la humedad atmosférica consiste simplemente en agua destilada en equilibrio de pH con CO 2 gaseoso. Los productos químicos adicionales también están presentes en concentraciones traza en la precipitación. Por ejemplo, en días ventosos, el polvo que contiene calcio y magnesio se sopla a la atmósfera, y la precipitación que contiene estos elementos puede desarrollar un pH superior a 5.65. Esto es especialmente cierto en los paisajes agrícolas y praderas, donde la superficie del suelo suele estar desnuda de cobertura vegetal y las partículas del suelo pueden erosionarse fácilmente en la atmósfera. En algunas otras regiones, una concentración relativamente alta de sulfato de origen natural en la atmósfera puede dar como resultado una precipitación que tiene un pH menor a 5.65.
Los cationes más abundantes (iones cargados positivamente) en precipitación son iones hidrógeno (H +), amonio (NH 4 +), calcio (Ca 2+), magnesio (Mg 2+) y sodio (Na +). Los aniones más abundantes (iones cargados negativamente) son sulfato (SO 4 2-), cloruro (Cl —) y nitrato (NO 3 -). Otros iones también están presentes, pero sólo en trazas que tienen poca influencia en el pH (ver En Detalle 19.2).
En Detalle 19.2: Conservación de Neutralidad Electroquímica
El principio de conservación de la neutralidad electroquímica establece que en cualquier solución eléctricamente neutra (una que no lleve carga eléctrica), el número total de cargas positivas asociadas a cationes debe ser igual al número total de cargas negativas de aniones. Para efectos de calcular un balance de cargas, las concentraciones de iones se miden en unidades conocidas como equivalentes. Estos se calculan como la concentración molar multiplicada por el número de cargas sobre el ión. (Cuando se trata de precipitación o aguas superficiales, los microequivalentes, o µeq, son generalmente las unidades reportadas.)
Este principio es relevante para la acidificación del agua. La concentración de H + se puede determinar como la diferencia en concentraciones de la suma de todos los equivalentes aniónicos menos la suma de todos los cationes distintos de H +. Por lo tanto, si los equivalentes totales de aniones superan los equivalentes totales de cationes distintos del ion hidrógeno, entonces H + debe entrar en solución para equilibrar el “déficit” de cationes, de la siguiente manera:
H + = (SO 4 2- + NO 3 — + Cl —) — (Na + + NH 4 + + Ca 2+ + Mg 2+)
La ecuación anterior ha demostrado ser útil en estudios de precipitación ácida. Antes de aproximadamente 1955, la medición del pH era algo inexacta. Sin embargo, hubo análisis confiables de otros iones importantes en aguas superficiales y precipitaciones. En tales casos, la ecuación puede ser utilizada para calcular valores de pH previos a 1955, proporcionando datos importantes para estudios del pH histórico en aguas sensibles a la acidificación.
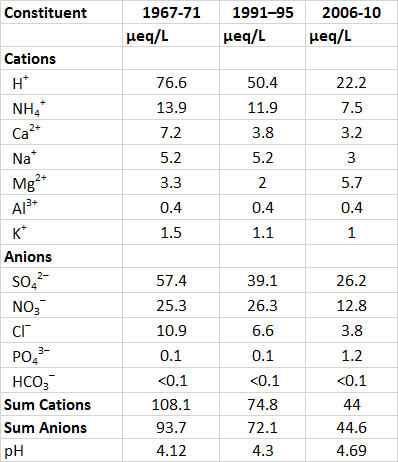
Uno de los registros más antiguos de química de precipitación es de un sitio de investigación en Hubbard Brook, New Hampshire, en una región expuesta a intensas deposiciones acidificantes. Durante 1967-1971, cuando la lluvia ácida fue relativamente severa, el pH promedio de la precipitación en Hubbard Brook fue de 4.1. Este nivel de acidez luego se relajó algo a pH 4.9 en 1991-1995 debido a la disminución de las emisiones industriales, particularmente del gas formador de ácido SO 2, y luego aún más en 2009-2013 debido a mayores disminuciones en las emisiones de SO 2 (Cuadro 19.1; ver En Detalle 19.2 para una explicación de equivalentes). El sulfato y el nitrato son los aniones más importantes en la precipitación, y de 1967-1971 ocurrieron representaron 88% de los equivalentes aniónicos. Durante 2009-2013 estos dos aún aportaron 87% de los equivalentes aniónicos, aunque sus cantidades totales fueron considerablemente menores. Estos datos sugieren que la mayor parte de la acidez en la precipitación ocurre como soluciones diluidas de ácidos sulfúrico y nítrico. Los eventos de precipitación en Hubbard Brook que son más ácidos están asociados con tormentas que han pasado por las grandes regiones metropolitanas de Boston, Nueva York y Nueva Jersey. Estas áreas tienen enormes emisiones de SO 2 y NO x, que son los gases precursores de gran parte del SO 4 2- y NO 3 —en precipitación ácida—.
Patrones espaciales
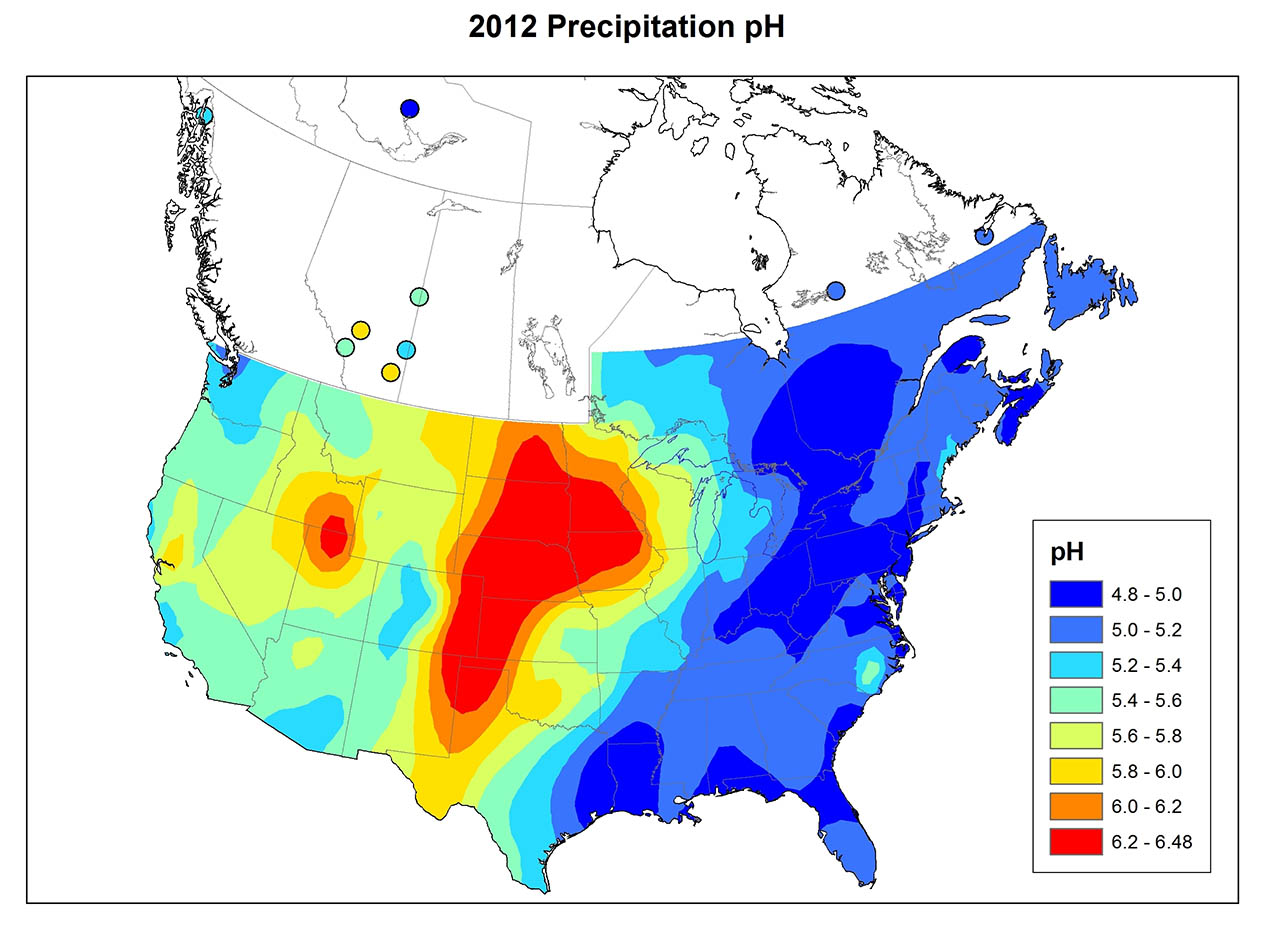
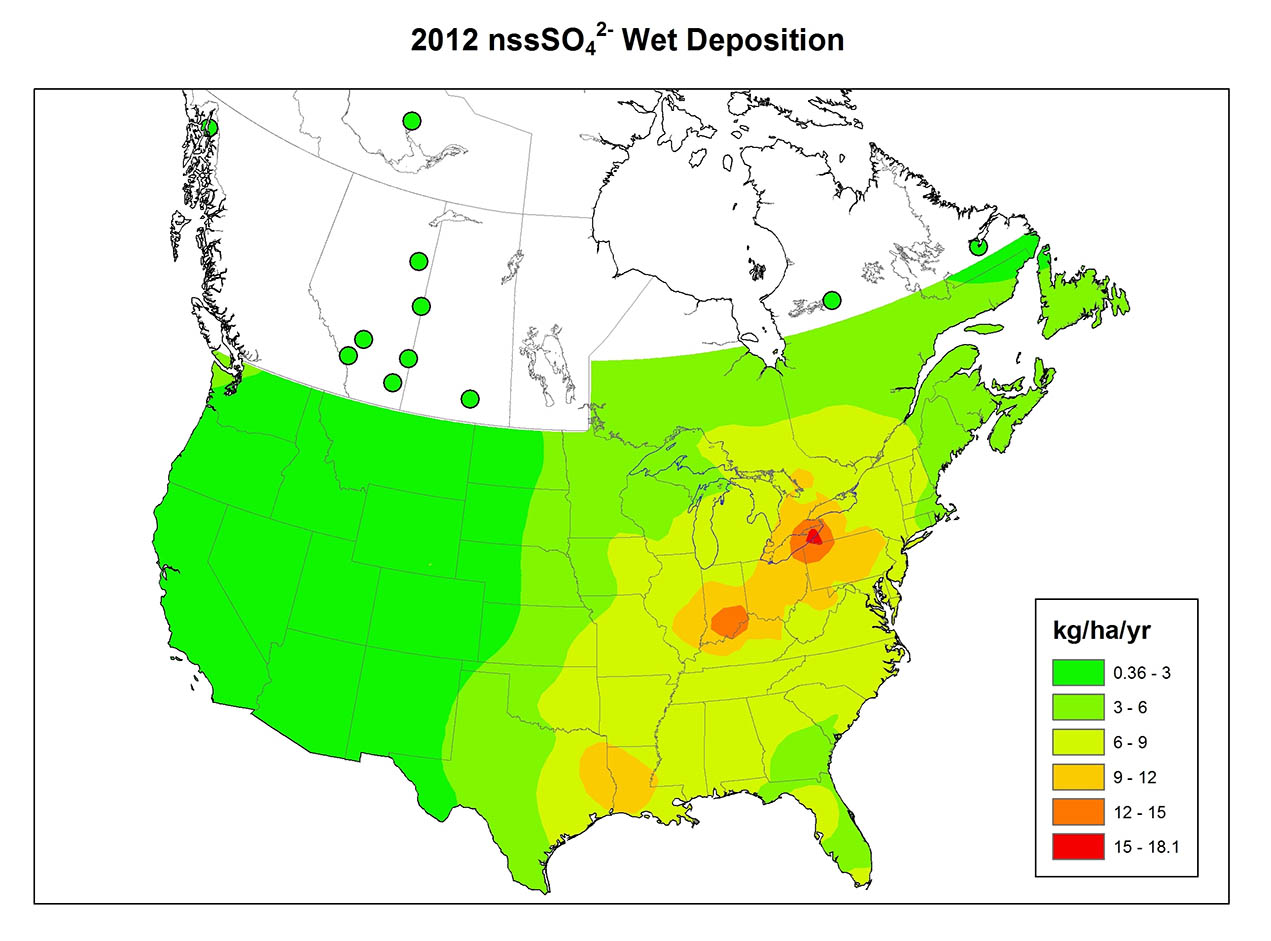
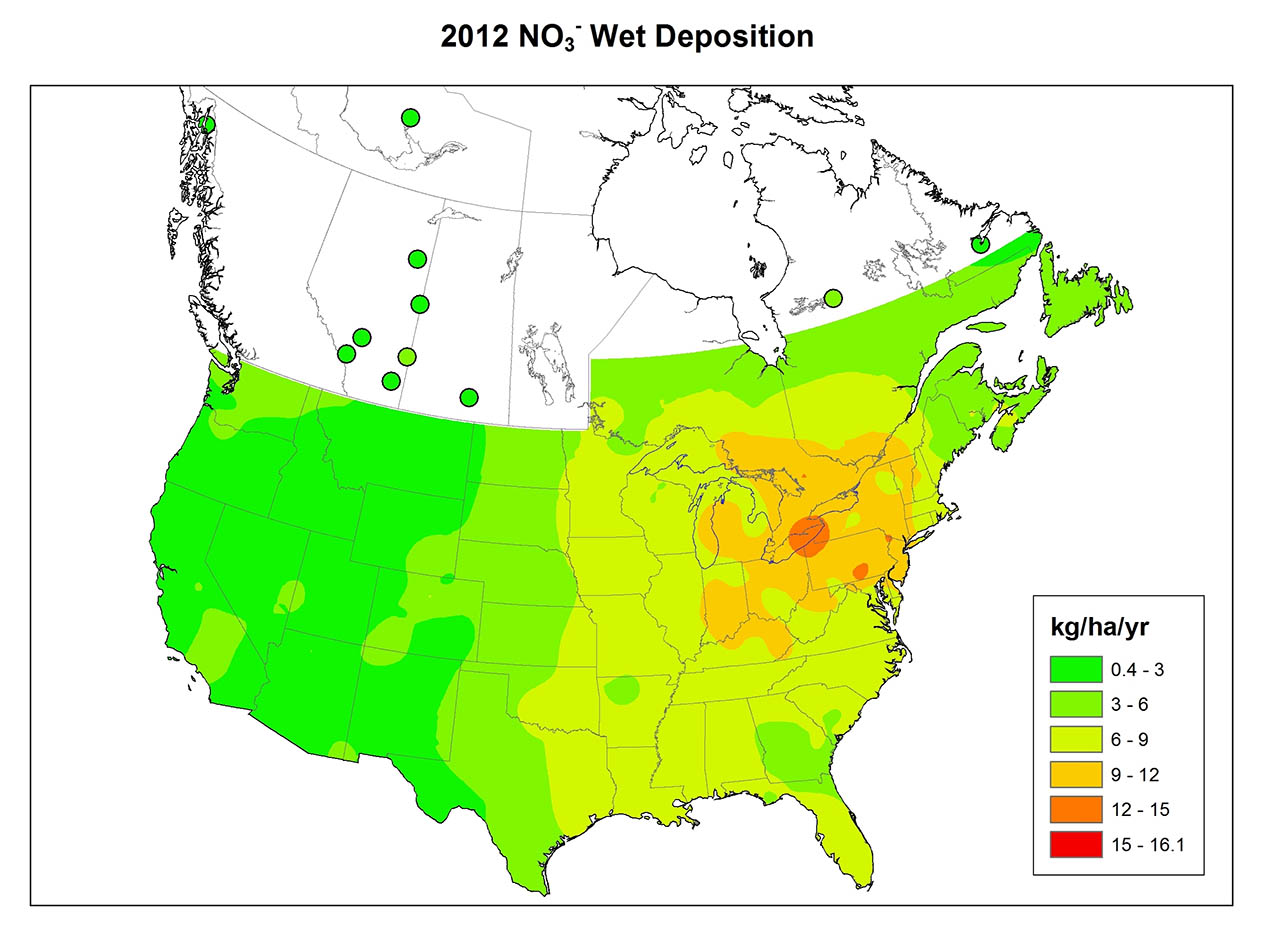
La precipitación ácida es un fenómeno generalizado en el este de América del Norte (Figura 19.1), Europa, Asia oriental y otros lugares. En el este de América del Norte antes de mediados de la década de 1950, las precipitaciones con pH por debajo de 4.6 afectaron solo a áreas relativamente locales, principalmente en el sur de Ontario, Nueva York, Pensilvania y Nueva Inglaterra. Desde entonces, sin embargo, esta área se ha expandido considerablemente. En la actualidad, la mayor parte del sureste de Canadá y el este de Estados Unidos experimenta precipitaciones ácidas. Parece que el patrón espacial en América del Norte existió antes de la década de 1950, pero desde entonces el fenómeno se ha generalizado y su intensidad ha aumentado. Uno de los aspectos más importantes de la precipitación ácida es el vasto tamaño de las áreas que afecta.
La química de la precipitación varía mucho entre regiones (Figura 19.1). La variación refleja los patrones de emisión de SO 2 y NO x, el grado de oxidación de esos gases a SO 4 2- y NO 3 -, la dirección predominante recorrida por las masas de aire contaminadas y la cantidad de polvo neutralizante de ácido en la atmósfera. El polvo atmosférico es particularmente importante cuando la cubierta vegetal es escasa, como en las regiones agrícolas donde las partículas diminutas del suelo son fácilmente erosionadas en la atmósfera por los fuertes vientos que soplan sobre los campos desnudos. Las carreteras sin pavimentar también son una fuente importante de polvo atmosférico.
La información sobre la química de la precipitación en cuatro sitios canadienses ampliamente separados se resume en el Cuadro 19.2. Dorset se encuentra en una zona rural centro-sur de Ontario, pero no muy al norte de la región densamente poblada del Gran Toronto (señalada como “continental poblado” en la tabla porque es un sitio interior cercano a grandes centros de población al sur). El terreno está sustentado por rocas duras del Escudo Precámbrico, como granito, gneis y cuarcita, y la cubierta vegetal es principalmente forestal. La precipitación es altamente ácida en la región Dorset, con un pH promedio de 4.1 y altas concentraciones de SO 4 2- y NO 3 -, lo que sugiere que la acidez se debe principalmente a ácidos sulfúrico y nítrico diluidos. Gran parte del sulfato y nitrato en precipitación se deriva de SO 2 y NO x emitidos por industrias y automóviles hacia el sur, los cuales luego son transportados en la atmósfera antes de ser depositados como depósitos acidificantes en la región de Dorset.
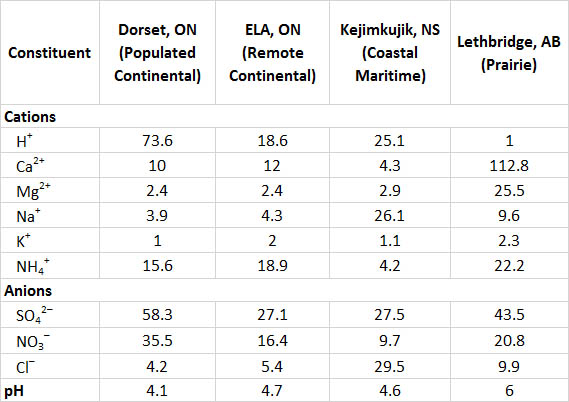
El sitio ELA (Experimental Lakes Area) se encuentra en una zona remota del noroeste de Ontario, cerca de Kenora (ver Canadian Focus 20.1). Al igual que Dorset, el ELA se encuentra en un paisaje en gran parte boscoso de Escudo Precámbrico, donde el lecho rocoso y el suelo están compuestos por minerales duros como el granito y el gneis. Sin embargo, el sitio ELA está mucho menos influenciado por las masas de aire afectadas por las emisiones antropogénicas (etiquetadas como “continental remoto”), por lo que su precipitación no es tan ácida (pH promedio 4.7) que en Dorset y tiene menos nitrato y sulfato.
El sitio de Kejimkujik, en el oeste de Nueva Escocia, también está sustentado por un duro lecho rocoso granítico y el terreno cercano está boscoso. Este sitio está distante de grandes fuentes de emisiones de SO 2 y NO x, pero a menudo recibe masas de aire que han pasado por zonas densamente pobladas en el noreste de Estados Unidos y el este de Canadá. Sin embargo, para cuando los sistemas de tormenta llegan a Kejimkujik, gran parte de su material ácido ha llovido, por lo que la precipitación local es solo moderadamente ácida (pH promedio 4.6). Kejimkujik también está influenciado por los sistemas meteorológicos oceánicos, por lo que su precipitación tiene altas concentraciones de sodio y cloruro que se derivan de la pulverización del mar. El agua salada oceánica tiene un pH de aproximadamente 8.0 debido a la presencia de químicos como el bicarbonato, por lo que los aerosoles marinos tienen una influencia neutralizante de ácidos en la precipitación en las regiones costeras.
Lethbridge se encuentra en un paisaje de pradera mixta de pasto en el sur de Alberta. La precipitación no es ácida (pH promedio 6.0) debido a la influencia neutralizante de partículas ricas en calcio y magnesio que son relativamente abundantes en la atmósfera. Estos se originan con polvo volado de campos agrícolas y carreteras. Este polvo también explica los abundantes Ca 2+ y Mg 2+ en la precipitación.
Los cambios rápidos en la química de la precipitación pueden ocurrir en la frontera entre un paisaje boscoso y áreas dominadas por praderas o tierras agrícolas. Un estudio en el sur de Ontario examinó la precipitación en ocho lugares en un área boscosa con suelo delgado y lecho rocoso precámbrico, y en tres sitios justo al sur del Escudo en terrenos agrícolas con suelo rico en calcio (Dillon et al., 1977). El pH promedio de precipitación entre los sitios Shield fue de 4.1-4.2, mientras que en los sitios al sur fue de 4.8-5.8. La precipitación fue menos ácida en el área agrícola debido a la influencia neutralizante local del polvo volado de campos y carreteras.

Otra característica importante de la precipitación ácida es que, a diferencia del SO 2 y las partículas metálicas, su intensidad no aumenta más cerca de grandes fuentes puntuales de emisiones, como una central eléctrica de carbón o una fundición. Por ejemplo, la precipitación no es más ácida cerca de la superpila en Sudbury que en la región más grande, sin embargo, esa es la fuente puntual más grande de Canadá de SO 2. Además, cuando esa fundición fue cerrada por una huelga en 1979, la acidez de la precipitación local no cambió —promedió el pH 4.49 durante la huelga de siete meses, en comparación con el pH 4.52 durante los siete meses anteriores cuando hubo grandes emisiones de SO 2 (Scheider et al., 1980).
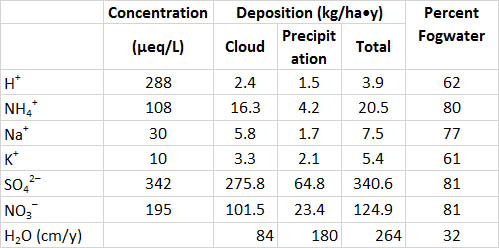
La humedad de la niebla también puede ser bastante ácida en el este de Norteamérica y en otros lugares. Las aguas de niebla recolectadas a altas elevaciones y en lugares costeros suelen ser más ácidas que pH 4.0, y pueden ser tan ácidas como pH 2.5-3.0. En sitios boscosos donde la niebla es una ocurrencia común, grandes cantidades de acidez y otros químicos son filtrados fuera de la atmósfera por los árboles. Esto ocurre porque diminutas gotas de agua suspendidas se unen en la superficie del follaje y la corteza a medida que la niebla pasa a través de un dosel del bosque, un proceso que elimina gran parte de las aguas de niebla de la atmósfera. Este fenómeno se ilustra en la Tabla 19.3 para un bosque de coníferas en una montaña que a menudo experimenta condiciones de niebla. El aporte total de humedad atmosférica a ese bosque fue de 264 cm/año, con lluvia y nieve representando 68% y niebla 32% (niebla estuvo presente 40% del tiempo). Sin embargo, las concentraciones de muchos químicos son mucho más altas en las aguas de niebla que en la precipitación —debido a que las gotas de agua suspendidas son diminutas, los químicos disueltos están menos “diluidos” por su matriz acuosa. Como resultado, las tasas de deposición de sustancias disueltas en el bosque pueden ser mayores que las de la precipitación. En esta ubicación particular, el agua de niebla representó 62% de la deposición de H + y 81% de las entradas de SO 4 2- y NO 3-.
Contaminación atmosférica transfronteriza
Las sustancias acidificantes y sus precursores gaseosos a menudo se transportan a largas distancias en la atmósfera, lejos de sus fuentes de emisión. Los químicos acidificantes no respetan las fronteras políticas, por lo que las emisiones que ocurren en un país pueden degradar ecosistemas y recursos valiosos en otros países. Este contexto transfronterizo ha ayudado a centrar la atención de los gobiernos en el problema de acidificar la deposición desde la atmósfera.
En Europa occidental, por ejemplo, los escandinavos argumentaron justificadamente que la mayor parte de la deposición acidificante que ha afectado a extensas regiones de su paisaje ha resultado de emisiones de SO 2 y NO x en Alemania e Inglaterra. Este contexto internacional europeo fue el primer caso bien demostrado del llamado LRTAP, acrónimo del transporte de larga distancia de contaminantes atmosféricos.
Circunstancias transfronterizas similares ocurren en otros lugares En el este de Norteamérica, existen grandes poblaciones y centros industriales en el noreste de Estados Unidos. Las emisiones de SO 2 y NO x de esas áreas a menudo fluyen hacia el este de Canadá, empeorando los daños causados allí por las emisiones locales. Las emisiones estadounidenses son responsables de aproximadamente 90% de la deposición húmeda de compuestos nitrogenados acidificantes en el este de Canadá, junto con 63% de la deposición húmeda de compuestos de azufre, 43% de la deposición seca de nitrógeno y 24% de la deposición seca de azufre (Shannon y Lecht, 1986). Canadá también exporta algunas de sus emisiones a Estados Unidos, aunque las emisiones canadienses representan menos del 5% de la deposición total de compuestos de azufre y nitrógeno en los estados orientales. En total, Canadá recibe alrededor de 4 millones de toneladas de SO 2 al año de Estados Unidos (Environment Canada, 1999).
Deposición en Seco
La deposición seca ocurre durante los intervalos entre eventos de precipitación, e incluye lo siguiente:
- la absorción directa de SO 2 y NO x gaseosos por la vegetación, el suelo y el agua
- sedimentación gravitacional de partículas más grandes
- el filtrado de partículas suspendidas por la vegetación
La deposición seca ocurre en todo tipo de hábitat, pero el bosque es particularmente efectivo para absorber gases y partículas de la atmósfera. Esto se debe a que los árboles tienen una superficie tan grande y compleja de follaje y corteza, lo que mejora en gran medida la tasa de deposición seca.
La deposición seca puede resultar en grandes entradas de sustancias de la atmósfera, incluyendo algunas que generan acidez cuando se transforman químicamente dentro del ecosistema. Por ejemplo, el SO 2 atmosférico se disuelve fácilmente en las aguas superficiales de lagos y arroyos. Este gas también es libremente absorbido por las plantas: ingresa al follaje a través de pequeños y abundantes poros en la superficie conocida como estomas, y luego se disuelve en la película húmeda de agua que cubre la superficie de las células en una cavidad subestomática. En este sentido, el SO 2 se comporta igual que el CO 2, nutriente vital, que también es absorbido por las plantas de esta manera. El SO 2 absorbido se oxida al anión sulfito (SO 3 2-), el cual se oxida rápidamente a sulfato (SO 4 2-). Debido a que el sulfato se equilibra electroquímicamente principalmente por iones hidrógeno, la acidez se genera por la transformación del gas SO 2 en el ion SO 4 2- (ver Figura 19.2).
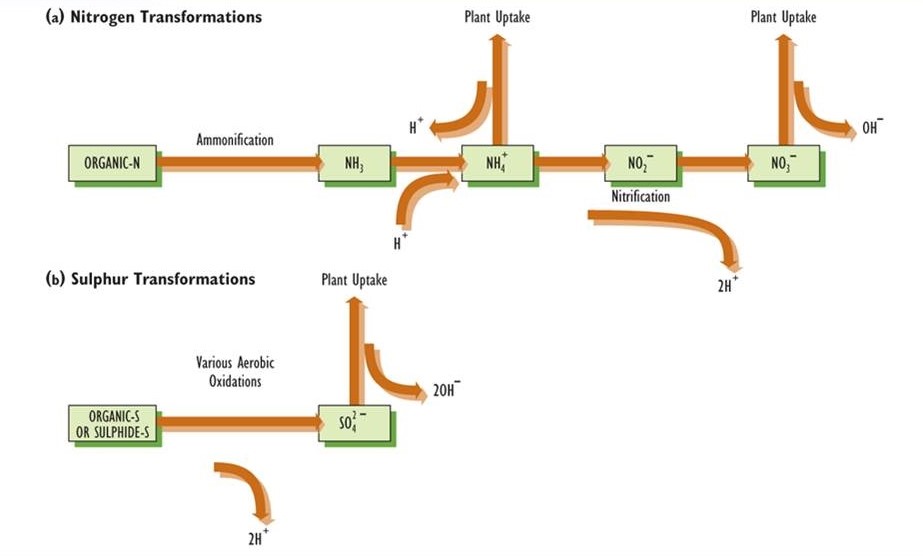
El NO x gas puede depositarse en seco de manera similar y luego oxidarse a nitrato (NO 3 -), lo que también genera una cantidad equivalente de H +. El gas amoníaco (NH 3) y el catión amonio (NH 4 +) también pueden depositarse en seco al suelo o al agua, donde pueden ser oxidados por bacterias a nitrato más cantidades equivalentes de H +.
Las tasas de deposición seca de compuestos de azufre y nitrógeno son mayores cuando hay altas concentraciones de NO x y SO 2 gaseosos en la atmósfera. Tales condiciones suelen ocurrir en áreas urbanas y cercanas a grandes fuentes industriales de emisiones. En esos lugares, la deposición seca representa insumos mucho más grandes de sustancias acidificantes que la deposición húmeda. En ambientes más remotos y menos contaminados, lejos de fuentes de emisión, los insumos con precipitación suelen ser más grandes que la deposición seca.
Dentro de 40 km de la fundición más grande de Sudbury, aproximadamente 55% de la deposición de azufre atmosférico ocurre como deposición seca (Chan et al., 1984). Alrededor del 91% de la deposición seca involucra SO 2 gaseoso, mientras que el resto son partículas de sulfato. Sin embargo, la superpila en esa fundición, siendo extremadamente alta (380 m), es efectiva para dispersar sus emisiones de SO 2. En consecuencia, menos del 1% del SO 2 emitido por esa fuente puntual se deposita cerca (en este caso, dentro de los 40 km). Más bien, casi todo el SO 2 se transporta mucho más lejos antes de depositarse en el paisaje.
Acidez del Suelo
La acidez del suelo es un factor importante que afecta el crecimiento de las plantas. La acidificación del suelo es un proceso natural que ha sido demostrado por estudios de sucesión en ecosistemas.
Un estudio bien conocido se realizó en Glacier Bay en Alaska. El derretimiento de un glaciar en un largo fiord está exponiendo un sustrato mineral de labranza que tiene un pH de aproximadamente 8.0 y contiene hasta 10% de minerales carbonatados de calcio y magnesio (Crocker y Major, 1955). Una vez expuesto, este material se modifica colonizando plantas y factores climáticos. La lluvia es especialmente importante, porque gran parte de ella se perfila a través del suelo y lixivia los químicos disueltos más allá de la profundidad de enraizamiento de las plantas. Estas influencias dan como resultado un aumento de la acidez del suelo, que alcanza aproximadamente pH 4.8 después de 70 años de sucesión, momento en el que se establece un bosque de coníferas. La acidificación se acompaña de grandes y progresivos descensos en las cantidades de Ca, Mg y carbonatos en el suelo durante la sucesión.
En parte, la acidificación es causada por la absorción de los nutrientes Ca, Mg y K por árboles y otras plantas, proceso que se acompaña de la excreción de H + y una disminución en la capacidad de amortiguación del suelo (esto se relaciona con la capacidad del suelo para resistir una mayor acidificación). La lixiviación de calcio y otros cationes fuera del suelo por el agua de lluvia también contribuye a la acidificación.
Diversos cambios químicos ocurren a medida que el agua de lluvia se filtra a través del suelo e interactúa con minerales, materia orgánica, microbios y raíces:
- Las raíces y los microorganismos absorben, liberan y transforman selectivamente productos químicos
- Los iones se intercambian en las superficies de partículas de arcilla, minerales y materia orgánica
- Los minerales insolubles se hacen solubles mediante los llamados procesos de meteorización, incluyendo reacciones con ácidos
- Se forman minerales secundarios, como ciertas arcillas y precipitados insolubles de óxidos de hierro y aluminio
Estas reacciones provocan cambios importantes en el suelo, como la acidificación, la lixiviación de calcio y magnesio, y la solubilización de metales, particularmente iones tóxicos del aluminio (como Al 3+; ver Capítulo 18). Todos estos procesos ocurren de forma natural donde la entrada de agua de la precipitación excede la cantidad devuelta a la atmósfera por la evapotranspiración, por lo que hay un excedente para filtrarse hacia abajo a través del suelo. Estas reacciones también están influenciadas por el tipo de vegetación que crece en el sitio. Por ejemplo, los pinos, abetos y encinas tienden a hacer que el suelo se acidifice. Además, la deposición de sustancias acidificantes de la atmósfera puede potencialmente aumentar las tasas de algunos de estos procesos en el suelo, y con ello incrementar la lixiviación de Al 3+ y H + tóxicos en arroyos y lagos.
Factores que afectan la acidez del suelo
La acidez del suelo está influenciada por numerosas transformaciones químicas e intercambios iónicos. Algunos son llevados a cabo por organismos, mientras que otros son reacciones no biológicas. Los siguientes son los factores más importantes que afectan la acidez del suelo.
- Ácido Carbónico. En muchos ecosistemas terrestres, como pastizales y bosques, la hojarasca superficial y el suelo superior son ricos en materia orgánica y raíces. La descomposición y respiración resultan en altas concentraciones de CO 2 (a menudo superiores al 1%) en la atmósfera dentro del suelo. Las altas concentraciones de CO 2 resultan en la formación de ácido carbónico (H 2 CO 3) en el agua del suelo, lo que contribuye a su acidificación. Este efecto es más fuerte en suelos con un pH mayor a aproximadamente 6.0, y no es importante en suelos ácidos con pH inferior a aproximadamente 5.5.
- El Ciclo del Nitrógeno. La acidez del suelo también puede verse afectada por las transformaciones microbianas de los compuestos nitrogenados y por su absorción y liberación por las plantas (Figura 19.2). El amonio (NH 4 +) y el nitrato (NO 3 -) son especialmente importantes porque las plantas deben tomar uno o ambos de estos nutrientes esenciales, la elección depende en gran medida de la acidez del suelo. En suelos con pH menor a aproximadamente 5.5, casi todo el nitrógeno inorgánico se presenta como NH 4 +. El NH 4 + puede originarse de la amonificación de nitrógeno orgánico para formar amoníaco (NH 3), un proceso llevado a cabo por muchas especies de microorganismos (ver Capítulo 5). El amoníaco absorbe un H + para formar amonio. Si el ion NH 4 + es absorbido por una raíz de planta, se excreta un H + en el suelo para mantener la neutralidad electroquímica, por lo que no hay cambio neto en la acidez. Sin embargo, si NH 4 + se agrega directamente al suelo (como por deposición atmosférica o por la aplicación de un fertilizante), entonces la absorción vegetal de NH 4 +, acompañada de la liberación de H +, tiene un efecto acidificante. En suelos con pH mayor a 5.5, la mayor parte del nitrógeno inorgánico se presenta como NO 3 -, el cual se produce por la oxidación de NH 4 + a través del proceso de nitrificación (Capítulo 5). La nitrificación es realizada por las bacterias Nitrosomonas y Nitrobacter, las cuales son intolerantes a la acidez. La oxidación de NH 4 + a NO 3 — genera dos H + (Figura 19.2). Si el NH 4 + se originó a partir de la amonificación de nitrógeno orgánico (que consume un H + por cada NH 4 + producido), el efecto neto es la liberación de un H + por cada NO 3 — producido a partir del nitrógeno orgánico. Sin embargo, si el NO 3 —es entonces absorbido por una raíz, un OH — se excreta al suelo para mantener la neutralidad electroquímica, lo que equivale al consumo de un H +. En ese caso, el efecto neto sobre la acidez del suelo es cero. Es bien sabido por los agricultores y agrónomos que la adición de amonio al suelo puede tener una influencia severamente acidificante. Esto sucede porque el NH 4 + se nitrifica en NO 3 -, lo que genera grandes cantidades de acidez. Existen dos tipos principales de insumos amónicos: el tratamiento de campos agrícolas con fertilizantes que contienen nitrógeno inorgánico (como urea o nitrato amónico), y la deposición de gas NH 3 y NH 4 + de la atmósfera.
- El Ciclo del Azufre. Gran parte del azufre en el suelo ocurre en formas orgánicamente unidas. Los procesos microbianos pueden transformar este azufre orgánico en compuestos más altamente oxidados, incluyendo sulfuros y azufre elemental, pero si el oxígeno es abundante, estos se oxidan aún más a sulfato. En general, la oxidación del azufre orgánico a SO 4 2- libera un equivalente de H + por equivalente de SO 4 2- producido (esto es lo mismo que dos H + por SO 4 2- SO 4 2- es absorbido por una raíz, una cantidad equivalente de OH — se excreta para conservar la neutralidad electroquímica, por lo que no hay efecto neto sobre la acidez. Sin embargo, si la deposición atmosférica provoca una entrada directa de SO 4 2- al suelo, seguida de la absorción por las raíces de las plantas, el efecto neto es una reducción de la acidez. Además, si el suelo es deficiente en oxígeno (anaeróbico), como ocurre comúnmente en sitios húmedos, entonces el SO 4 2- puede ser transformado por microbios en un compuesto de sulfuro, lo que resulta en el consumo de una cantidad equivalente de H + y una reducción de la acidez.
Las reacciones asociadas al ciclo del azufre suelen tener un menor efecto sobre la acidez del suelo que las que involucran el ciclo del nitrógeno. En ciertas situaciones, sin embargo, el ciclo del azufre es dominante. Por ejemplo, cuando se drena un humedal, su sedimento previamente anaeróbico se vuelve aeróbico. Esto permite que las bacterias oxiden compuestos de sulfuro reducido en sulfato. Algunos humedales drenados desarrollan una condición extremadamente ácida conocida como suelo de sulfato ácido. Durante 10 o más años después de que ocurra el drenaje, generalmente para desarrollar tierras agrícolas, el pH puede ser inferior a 3.0. Esto perjudica gravemente el crecimiento de los cultivos, aunque la acidez se puede neutralizar agregando carbonato de calcio (cal) al suelo.
En ocasiones, los minerales sulfurados como la pirita (sulfuros de hierro) se exponen al oxígeno atmosférico. Esto permite que bacterias Thiobacillus especializadas oxiden los sulfuros, proceso que produce iones sulfato y hierro oxidado, de acuerdo con la siguiente reacción: 4 FeS 2 + 15 O 2 + 14 H 2 O → 4 Fe (OH) 3 + 16 H + 8 SO 4 2-
Este fenómeno, conocido como drenaje ácido-mina (o como drenaje ácido-roca), provoca una severa acidificación del suelo y las aguas superficiales. Puede provocar que se desarrolle un pH menor a 2.0, con altas concentraciones de sulfato e iones tóxicos de aluminio y hierro. El drenaje ácido-mina es un problema importante donde la minería de carbón y metal han expuesto los sulfuros minerales a la atmósfera (ver En Detalle 19.3).
- Absorción de Cationes Básicos por Plantas. Las plantas terrestres obtienen muchos de sus nutrientes al absorber iones del suelo en el que están creciendo. (Algunos nutrientes, sin embargo, son absorbidos principalmente de la atmósfera, particularmente CO 2.) El calcio, el magnesio y el potasio son nutrientes importantes que se absorben del suelo como cationes (Ca 2+, Mg 2+ y K+), cuya absorción se compensa con una liberación de H +. En los ecosistemas naturales, el Ca 2+, Mg 2+ y K+ absorbidos finalmente son devueltos al suelo con hojarasca, por lo que no hay efecto a largo plazo sobre la acidez del suelo. Sin embargo, si se elimina la biomasa del sitio, como ocurre en la agricultura y la silvicultura, estos cationes se eliminan, resultando en la acidificación del suelo.
- Lixiviación de Iones. En la mayoría de los suelos, los aniones nitrato y cloruro se filtran fácilmente hacia abajo en el agua subterránea. Hacen esto porque son altamente solubles en agua, y solo se retienen débilmente en sitios de intercambio de aniones sobre materia orgánica y arcillas. Los aniones lixiviados pueden llegar eventualmente a aguas superficiales como arroyos y lagos. Esto también es cierto en el caso del sulfato, especialmente en suelos relativamente jóvenes de regiones glaciadas, incluyendo la mayor parte de Canadá (los suelos más antiguos de las regiones más meridionales suelen tener una mayor capacidad para retener sulfato). En áreas con grandes insumos de sustancias acidificantes, las cantidades de NO 3 —y SO 4 2- en el suelo pueden ser lo suficientemente altas como para dar como resultado tasas sustanciales de lixiviación. A medida que estos aniones se lixivian del suelo, van acompañados de cationes como Ca 2+, Mg 2+, H + y Al 3+, lo que resulta en acidificación, pérdida de nutrientes y toxicidad (asociada al Al 3+) en ecosistemas terrestres y acuáticos. Por ejemplo, se encontró que una cuenca monitoreada en el centro-sur de Ontario perdió 30% del calcio de su suelo entre 1983 y 1999 (Watmough y Dillon, 2004).
Deposición Atmosférica y Suelo
Los efectos potenciales de la deposición atmosférica sobre la acidez del suelo han sido estudiados en experimentos en los que se agregaron soluciones simuladas de agua de lluvia al suelo contenido en cilindros de plástico, conocidos como lisímetros. Estos experimentos han demostrado que las soluciones extremadamente ácidas pueden causar estos cambios en la química del suelo:
- un aumento en la acidez
- aumento de la lixiviación de calcio, magnesio y potasio, resultando en su agotamiento y mayor vulnerabilidad del suelo a la acidificación
- aumento de la solubilización de iones metálicos tóxicos, especialmente de aluminio, pero también de hierro, manganeso y otros
- una abrumadora de la capacidad del suelo para absorber sulfato, después de lo cual este ion lixivia libremente, a una tasa similar a su entrada (debido a que SO 4 2- es un anión, su lixiviación va acompañada de cationes base y Al 3+ y H + tóxicos, lo que puede contribuir a la acidificación y toxicidad de las aguas superficiales.)
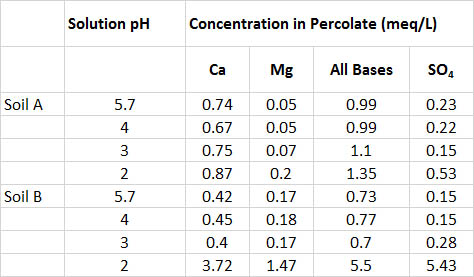
Un experimento consistió en el tratamiento de un suelo arenoso de rodales de pino gato con agua de lluvia simulada, ajustada con ácido sulfúrico a un pH de 5.7, 4.0, 3.0 o 2.0 (Cuadro 19.4). Incluso el tratamiento con el pH extremadamente ácido 2.0 tuvo poco efecto sobre la acidez del suelo, y las soluciones de percolación tuvieron un pH superior a 6.5 en todos los tratamientos. Sin embargo, la lixiviación de Ca, Mg, bases totales (Ca + Mg + K + Na) y sulfato fueron mucho mayores en el tratamiento de pH 2.0. En general, este experimento encontró que el suelo era bastante resistente a los efectos de la carga ácida. Eventualmente, sin embargo, la resistencia podría superarse mediante el tratamiento con soluciones altamente ácidas, y tal vez por la exposición a largo plazo a acidedades más moderadas. Tenga en cuenta que experimentos como estos son investigaciones a corto plazo, mientras que la acidificación del suelo en la naturaleza es un proceso lento y a largo plazo.
Los investigadores que monitorean la química del suelo en lugares particulares del campo pueden determinar si se ha producido la acidificación, aunque dichos estudios no necesariamente identifican las causas del cambio. Por ejemplo, la conversión de tierras agrícolas en bosque de coníferas generalmente resulta en la acidificación del suelo. En el sur de Ontario, la forestación de tierras de cultivo abandonadas con pino o abeto provocó que el suelo se acidificara de pH 5.7 a pH 4.7 después de 46 años de desarrollo forestal (Brand et al., 1986). Se entiende menos si los sitios ya boscosos se volverán más ácidos debido a las entradas atmosféricas de sustancias acidificantes. Un estudio en el sur de Ontario volvió a muestrear suelos forestales después de un intervalo de 16 años, en una región donde el pH promedio de precipitación es de aproximadamente 4.1, pero no se observó más acidificación del suelo (Linzon y Temple, 1980).
En general, estudios realizados en otras partes de Canadá, Estados Unidos y Europa, también han llegado a conclusiones ambiguas sobre los efectos de la deposición atmosférica en la acidificación del suelo. A excepción de los casos en que la atmósfera está severamente contaminada por SO 2, como cerca de una fundición de metal, no hay evidencia convincente de que la deposición atmosférica haya acidificado el suelo a gran escala. Parece que la acidificación del suelo es un riesgo potencial a largo plazo asociado a este tipo de contaminación.
Vegetación Terrestre
Numerosos estudios han demostrado que las plantas pueden resultar lesionadas por el tratamiento con “lluvia ácida” simulada. En casi todos los estudios, sin embargo, el pH que causó lesiones agudas fue más ácido de lo que normalmente se encuentra en la precipitación ambiental.
Por ejemplo, experimentos en Noruega expusieron rodales jóvenes de coníferas a lluvia ácida simulada durante tres años (Tveite, 1980). El tratamiento testigo fue pH 5.6-6.1, mientras que los tratamientos acidificados utilizaron pH 4.0 o 3.0. En promedio, los plantones control de pino lodgepole (Pinus contorta) crecieron 15-20% menos que las plantas que recibieron los tratamientos ácidos. El crecimiento de pino escocés (P. sylvestris) y abedul (Betula pendula) también fue estimulado por los tratamientos ácidos, mientras que el abeto (Picea abies) no se vio afectado. Sin embargo, la vegetación molida dominada por musgo fue severamente dañada por el tratamiento más ácido (pH 3.0).
Los experimentos de laboratorio también son útiles para determinar los efectos del pH del agua de lluvia en las plantas, ya que las condiciones ambientales pueden controlarse bien. En general, tales experimentos no encuentran reducciones de crecimiento hasta que el pH se vuelve más ácido que aproximadamente 3.0 (para comparación, la acidez promedio de la precipitación es de aproximadamente pH 4.0 en regiones donde la lluvia ácida se considera un problema grave). Además, la productividad de algunas especies tolerantes puede ser estimulada por el agua de lluvia aún más ácida que pH 3.0. Por ejemplo, las plántulas de pino blanco (Pinus strobus) crecieron más rápidamente cuando se expusieron a neblina ácida que variaban de pH 2.3 a 4.0 que a pH 5.6 (Wood y Bormann, 1976). En otro experimento, plántulas de 11 especies arbóreas fueron tratadas con soluciones de diversos pH, pero el daño agudo al follaje fue causado solo después de una semana de tratamiento a pH 2.6, lo que es una exposición antinaturalmente ácida (Percy, 1986).
En general, parece que los árboles y otras plantas vasculares tienen poco riesgo de sufrir lesiones agudas por exposición a la lluvia ácida ambiental. Sin embargo, los estreses asociados a la precipitación ácida podrían disminuir el crecimiento de las plantas, incluso en ausencia de lesiones agudas. Estas “lesiones ocultas” (ver Capítulo 16) podrían ser causadas por una sutil alteración del metabolismo de las plantas, o indirectamente por cambios en la química del suelo. Debido a que la precipitación ácida afecta a regiones extensas, incluso una pequeña disminución en la productividad de la planta podría tener importantes consecuencias económicas y ecológicas.
Las lesiones ocultas, si ocurren, son más relevantes para el bosque y otros tipos de vegetación natural. La tierra agrícola se acidifica principalmente a través de prácticas de manejo, como el cultivo y el uso de fertilizantes nitrogenados. Además, el suelo agrícola es tratado rutinariamente con agentes de encalado para reducir su acidez.

Varios estudios realizados en el este de Norteamérica y Europa han examinado los efectos potenciales de las precipitaciones ácidas sobre la productividad forestal. Si bien las especies de árboles en algunas regiones han mostrado recientes disminuciones en la productividad, no se ha demostrado de manera concluyente que estos cambios fueron causados por precipitaciones ácidas u otros tipos de contaminación atmosférica. La productividad forestal disminuye naturalmente a medida que madura un rodal, principalmente porque el cierre del dosel intensifica la competencia entre los árboles. La productividad forestal también está influenciada por factores como el cambio climático y las prácticas de manejo. Hasta el momento, la investigación de campo no ha separado claramente ninguna influencia de la precipitación ácida sobre la productividad forestal de los efectos relacionados con la sucesión, el cambio climático, la defoliación de insectos u otros factores. Sin embargo, algunos estudios de modelización del crecimiento han sugerido que la productividad podría disminuir en un 10% en el este de Canadá si se exceden las tasas críticas de deposición de sulfato y nitrato (Natural Resources Canada, 1998).
Claramente, los efectos de las deposiciones acidificantes sobre el suelo y la vegetación son algo ambiguos. Sin embargo, como mostrarán las siguientes secciones, los efectos en los ecosistemas vulnerables de agua dulce pueden ser severos.
Aguas Superficiales
Las aguas superficiales incluyen arroyos, ríos, lagos y estanques. Su química está influenciada por los tipos de suelo y vegetación en la cuenca hidrográfica, los factores climáticos y la deposición de químicos de la atmósfera.
En regiones donde los inviernos son fríos y se acumula una capa de nieve, el agua de deshielo primaveral que desemboca en arroyos y lagos tiende a ser relativamente ácida. Este llamado fenómeno de choque ácido ocurre en parte porque el deshielo de nieve no puede filtrarse en el suelo congelado, por lo que su acidez no se neutraliza por la interacción con los minerales allí. Además, las aguas de deshielo iniciales son considerablemente más ácidas que las fracciones posteriores. La acidez relativamente intensa del deshielo es responsable de gran parte de la toxicidad de las aguas superficiales afectadas.
La química del agua de dos lagos en una región de Nueva Escocia que está sujeta a precipitación ácida se describe en el Cuadro 19.5. Estos lagos son más diluidos que la mayoría de las aguas dulces, en el sentido de tener una baja concentración de iones disueltos, y su suministro de nutrientes es escaso, por lo que son improductivos (oligotróficos). Sin embargo, estos lagos tienen mayores concentraciones de sustancias disueltas que la precipitación que cae sobre ellos, sus iones totales promedian 440 µEq/L, en comparación con 135 µEq/L en precipitación. Las concentraciones más altas se deben a sustancias que se filtran del suelo terrestre y eventualmente migran al agua del lago. En contraste, las concentraciones de amonio y nitrato son mayores en precipitación que en los lagos, lo que sugiere que los insumos atmosféricos de estos nutrientes son “consumidos” por la absorción biológica dentro de la cuenca hidrográfica.
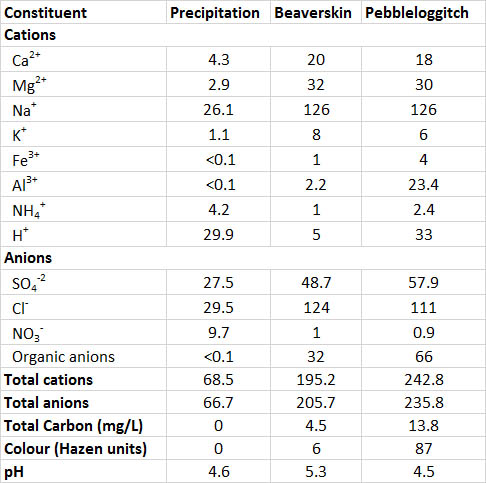
El Lago Piel de Castor es ligeramente ácido (pH 5.3) y oligotrófico, con agua muy transparente. En comparación, el lago Pebbleloggitch está influenciado por el drenaje de un pantano adyacente. Los compuestos orgánicos disueltos (conocidos como ácidos fúlvicos) drenan del pantano hacia el lago, dando al agua del lago un color marrón oscuro y una acidez (pH 4.5) similar a la precipitación. Aunque estos dos lagos se encuentran a solo 1 km de distancia, difieren notablemente en acidez debido a los ácidos orgánicos en el lago Pebbleloggitch color té. En general, las aguas influenciadas por los pantanos son naturalmente ácidas, comúnmente con una acidez de pH 4.0-5.0.

Acidificación de Aguas Superficiales
Una acidificación generalizada de las aguas superficiales en el este de Canadá se ha atribuido a la deposición de sustancias acidificantes de la atmósfera. El este de Estados Unidos y Escandinavia también se han visto afectados de esta manera.
Un estudio de aguas superficiales fue realizado por la Agencia de Protección Ambiental en Estados Unidos (Baker et al., 1991). En una muestra nacional de 28,300 lagos, 1,180 fueron ácidos, la mayoría de los cuales se encuentran en estados orientales. Se pensó que la deposición atmosférica había acidificado 75% de los lagos ácidos, mientras que 3% fueron afectados por drenaje ácido-mina y 22% por acidez de pantanos. De 64,300 corrientes muestreadas, 4,670 fueron ácidas, de las cuales 47% fueron acidificadas por deposición atmosférica, 26% por drenaje ácido-mina y 27% por pantanos. Florida tiene la mayor frecuencia de lagos ácidos, principalmente debido a los ácidos orgánicos de los humedales naturales. La influencia de la deposición atmosférica es más importante en los estados del noreste, particularmente en las montañas Adirondack, donde 10% de los lagos tienen un pH ≤5.0, y 20% tienen un pH ≤5.5.
Si bien en Canadá no se ha llevado a cabo un estudio tan exhaustivo del estado de los lagos y arroyos, se sabe que las aguas superficiales acidificadas son comunes, particularmente en las provincias orientales. Se ha estimado que existen más de 14,000 lagos ácidos en Ontario, Quebec y las Provincias Atlánticas (Environment Canada, 1996). La sensibilidad de las aguas superficiales a la acidificación está relacionada con la cantidad de alcalinidad en su agua, la cual a su vez se asocia con las cantidades de calcio y magnesio en el suelo y rocas de la cuenca (ver la siguiente sección). Las aguas superficiales en el 46% de la superficie de Canadá (alrededor de 4.0 millones de kilómetros cuadrados) se consideran altamente sensibles a la deposición acidificante, y otro 21% (1.8 millones de km 2) son moderadamente sensibles.
Los cambios químicos y biológicos que ocurren a medida que las aguas superficiales se acidifican han sido examinados en importantes estudios en los que deliberadamente se agregó ácido sulfúrico a los lagos (Schindler, 1990). Estos experimentos de lagos enteros se realizaron en el Área Experimental Lakes (ELA) del noroeste de Ontario. El lago más estudiado, llamado Lago 223, es un cuerpo de agua oligotrófico de 279 ha. El lago 223 se estudió durante dos años antes de ser acidificado experimentalmente, y luego durante varios años después. A partir de 1976, se añadió ácido sulfúrico para acidificar el lago, lo que redujo su pH de 6.5 inicialmente a 5.0-5.1 durante 1981-1983. Posteriormente, se permitió que su acidez disminuyera a pH 5.5-5.8 durante 1984-1988.
Como era de esperar, las concentraciones de sulfato e iones hidrógeno aumentaron en el lago 223, debido a que estos se agregaron al lago. El sulfato promedió 35 µmol/L en 1975, en comparación con 115 µmol/L en 1979. El aumento de las concentraciones de manganeso (un incremento del 980% para 1980), zinc (550%) y aluminio (155%) se produjo debido a que estos químicos se disolvieron del sedimento bajo las condiciones acidificadas. La acidificación también provocó que el agua se volviera más transparente, lo que permitió una mayor penetración de la luz y un calentamiento más profundo durante el verano. También ocurrieron muchos cambios biológicos; estos se describen más adelante en este capítulo.
En Detalle 19.3. Drenaje ácido-roca.
El drenaje ácido-roca (ARD; también conocido como drenaje ácido-mina) se refiere a flujos de agua que han sido severamente acidificados por la oxidación de pirita y otros minerales de azufre reducido. La ARD generalmente involucra contaminación asociada con la minería del carbón, pero también puede estar asociada con la minería metálica. La acidez se produce por la exposición de minerales piriticos, generalmente sulfuro de hierro, al oxígeno atmosférico, lo que permite que bacterias Thiobacillus especializadas oxiden los sulfuros y produzcan iones sulfato y hierro oxidado, de la siguiente manera: 4 FeS 2 + 15 O 2 + 14 H 2 O → 4 Fe (OH) 3 + 16 H + + 8 SO 4 2-
Tenga en cuenta el gran número de H + que se producen, estos pueden conducir a condiciones severamente ácidas en el agua que drena de los sustratos donde ocurren las reacciones. De hecho, el drenaje ácido-mina comúnmente resulta en un pH menor a 2.0, junto con altas concentraciones de sulfato y aluminio tóxico, hierro y manganeso. Si el ARD está asociado con rocas o relaves de la minería metálica, también puede ser rico en cobre tóxico, níquel u otros metales pesados.
A medida que una corriente fluye lejos de una fuente de ARD, interactúa con minerales neutralizantes y también puede recibir entradas de agua no ácida. Estos hacen que la acidez se reduzca, por lo que el pH aumenta gradualmente. Una vez que el pH se recupera más allá de aproximadamente 3.0, el hierro disuelto sale de la solución como un precipitado amarillo-naranja de Fe (OH) 3, a veces conocido como “amarillo-chico”. A medida que el niño amarillo se asienta sobre el lecho del arroyo, puede asfixiar a los organismos que habitan en el fondo.
Dondequiera que ocurra, el drenaje ácido-roca es un problema ambiental grave, principalmente porque es tan tóxico para la vida acuática. En consecuencia, se realizan esfuerzos para prevenir la ARD en la fuente, o para tratarla una vez que haya ocurrido. En Canadá, los trabajos para abordar la ARD se concentran bajo el programa de Drenaje Neutral en Ambiente Mino (MEND) de Natural Resources Canada. Se ha estimado que el “pasivo” total de ARD equivale a 2-5 mil millones de dólares si no se atienden los problemas.
Cuando sea posible, es prudente evitar la ARD impidiendo la exposición a la atmósfera de rocas que contienen sulfuro. Las minas de metal y las industrias de la construcción a menudo logran esto almacenando relaves de sulfuro bajo el agua. Sin embargo, todavía hay muchos casos en los que causan ARD y necesitan tratarla para reducir su toxicidad. La forma habitual de mitigar la ARD es agregar un agente de encalado, como la piedra caliza (CaCo 3) o la cal (Ca (OH) 2), que neutraliza el contenido de ácido. En algunos casos, se han construido “humedales artificiales” para hacer frente al problema: el ARD es insumo en un extremo del humedal y sale en el otro, habiéndose consumido gran parte de su contenido ácido por microbios que viven en sedimentos anaerobios. Esto sucede porque los iones sulfato (SO 4 2-) se reducen químicamente a sulfuros, como sulfuro de hierro (FeS 2) o sulfuro de hidrógeno (H 2 S). Estas reacciones consumen acidez, mientras que también provocan que los iones metálicos tóxicos precipiten de la solución.
Vulnerabilidad a la acidificación
Las aguas superficiales que son vulnerables a la acidificación tienen una baja alcalinidad, o capacidad de neutralización de ácidos. A medida que se agrega H + al agua, es absorbido por reacciones de neutralización ácida hasta que se excede la capacidad de neutralizar el ácido. Después de ese punto, se produce una rápida disminución del pH, hasta que entra en juego un sistema de tamponamiento diferente (Figura 19.3). La alcalinidad del bicarbonato (HCO 3 -) es el sistema de tamponamiento crítico dentro del rango de pH circunneutro de 6.0-8.0. Cuando se agota la capacidad de amortiguación del HCO 3 disponible, el agua se acidifica rápidamente. El bicarbonato reacciona con H + para formar H 2 O + CO 2. Debido a que esta reacción neutraliza el H + agregado, el pH no cambia hasta que se agota la alcalinidad.
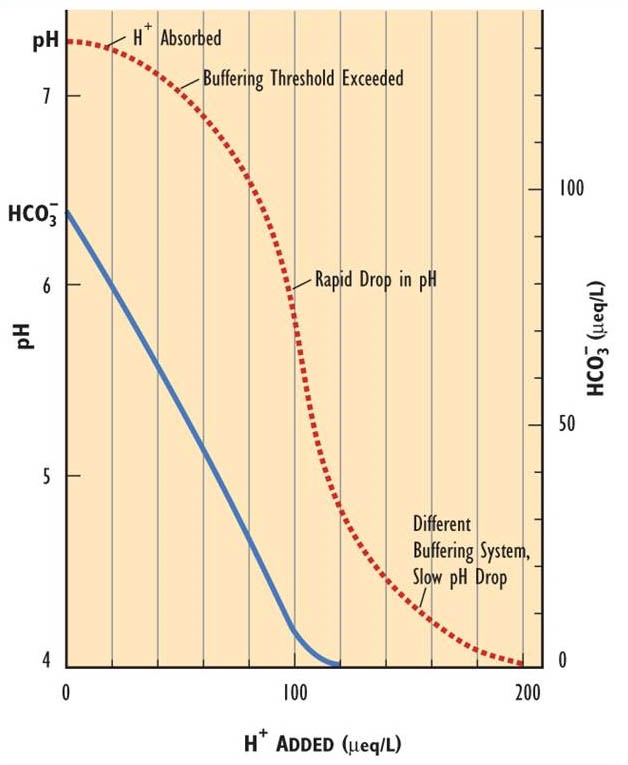
La concentración de bicarbonato en aguas naturales está influenciada por factores geoquímicos, especialmente por la presencia de piedra caliza (CaCo 3) o dolomita (Ca, MgCO 3) en el suelo o lecho rocoso de la cuenca o en el sedimento acuático. A medida que estos minerales se disuelven, crean alcalinidad de bicarbonato y le dan al agua un grado de capacidad neutralizante de ácidos. Si los minerales ricos en carbonato son abundantes en una cuenca hidrográfica, pueden generar suficiente alcalinidad para neutralizar los insumos acidificantes de la atmósfera. En consecuencia, las aguas superficiales en este tipo de cuencas hidrográficas no son sensibles a la acidificación, incluso en una región donde la atmósfera y la precipitación están contaminadas (excepto quizás en casos de tasas extremadamente altas de deposición seca de SO 2).
La situación es diferente, sin embargo, en cuencas hidrográficas en las que el lecho rocoso, el suelo y el sedimento se derivan de rocas duras y poco solubles como el granito, el gneis y la cuarcita, que contienen pocos minerales carbonatados. Las cuencas hidrográficas de este tipo tienen poca capacidad para generar alcalinidad y por lo tanto son fácilmente acidificadas por deposiciones húmedas y secas de la atmósfera. Las cuencas hidrográficas vulnerables son especialmente comunes en el este de Canadá, donde los suelos delgados derivados de la labranza glacial pobre en carbonato comúnmente se superponen a un lecho rocoso granítico duro.
Los lagos y arroyos de cabecera corren un riesgo particular de acidificación. Estos sistemas no reciben drenaje de cuerpos de agua a mayor altitud, y sus cuencas suelen ser pequeñas. En consecuencia, hay pocas oportunidades para que el agua de lluvia interactúe con el suelo y el lecho rocoso, y gran parte de la acidez en la precipitación no se neutraliza antes de que el agua llegue a los lagos y arroyos de cabecera.
A gran altura en muchas regiones montañosas, el granito de la corteza está expuesto por la erosión y el terreno en tales regiones también puede ser vulnerable a la acidificación. Este es el caso en partes de las Montañas Rocosas del oeste de América del Norte y en los Apalaches del este de Estados Unidos. Nuevamente, la vulnerabilidad ocurre porque el granito aporta poca alcalinidad a las aguas superficiales.
Sin embargo, dentro de una región vulnerable, incluso una pequeña bolsa de suelo rico en calcio en la cuenca puede proporcionar suficiente alcalinidad para permitir que una masa de agua resista la acidificación. Por ejemplo, se encuestaron 15 lagos en una zona del Escudo Precámbrico en el sur de Ontario donde la precipitación es bastante ácida (Dillon et al., 1977). Catorce de los lagos presentaron poca alcalinidad (95-175 µEq/L), fueron ligeramente ácidos (pH 5.8—6.7) y se consideraron altamente vulnerables a la acidificación. Un lago, sin embargo, tenía algunos talones ricos en calcio en su cuenca. Ese lago tenía una alta alcalinidad (1,200 µEq/L) y pH alto (7.1), y es poco probable que se acidifice.
Un tema relacionado es la pérdida gradual de calcio y magnesio de la cuenca hidrográfica terrestre debido a los largos períodos de lixiviación por aguas subterráneas ácidas. Finalmente, el suministro de esos cationes también se agota en arroyos oligotróficos y lagos con concentraciones naturalmente diluidas de iones, que son comunes en regiones de roca granítica, como en el Escudo Precámbrico. El agotamiento de calcio y magnesio representa un agotamiento de la capacidad neutralizante de ácidos de un cuerpo de agua, y es un problema fisiológico para los organismos que necesitan grandes cantidades de esos cationes para formar sus cáscaras de carbonato de calcio (como mejillones) o quitina (un polisacárido derivado de glucosa que necesita calcio para endurecer). La ocurrencia de osteoporosis acuática se ha demostrado en lagos del este de Canadá, y investigaciones adicionales probablemente mostrarán que es un problema generalizado (Jeziorski et al., 2008).
Organismos de agua dulce
Muchos cambios ocurren en la biota a medida que los ecosistemas de agua dulce se acidifican. En general, los organismos de agua dulce son considerablemente más sensibles a la acidificación de su hábitat que las plantas terrestres.
Algas de Agua Dulce
Muchas especies de algas microscópicas unicelulares (fitoplancton) viven en lagos. La química del agua influye mucho en las especies particulares que están presentes. Debido a que las especies de diatomeas (familia Bacilliarophyceae) y algas doradas (Chrysophyceae) son particularmente sensibles, son indicadores útiles de la química del agua. Por ejemplo, un estudio de 72 lagos en el área de Sudbury encontró que ciertas especies de diatomeas eran indicadores de aspectos particulares de la química del agua (Dixit et al., 1991):
- indicadores de agua ácida: Eunotia pectinatus, Fragilaria acidobiontica, Pinnularia subcapitata, Tabellaria quadriseptata
- indicadores de agua ácida con alto contenido de metales (Cu, Ni): Eunotia exigua, E. tenella, Frustulina rhomboides saxonica, Pinnularia hilseana
- indicadores de agua no ácida: Achnanthes lewisiana, Cyclotella meneghiniana, Fragilaria construens, F. crotonensis Las paredes celulares ricas en sílica de diatomeas difieren en forma para cada especie, y persisten en los sedimentos lacustres después de la muerte de la célula. También se conocen los requisitos de química del agua de muchas especies de diatomeas. En consecuencia, la abundancia de fósiles de diatomeas en capas fechadas de núcleos de sedimentos de lagos se puede utilizar para inferir comunidades históricas y química del agua. Esta técnica se ha utilizado para demostrar que algunos lagos actualmente ácidos en el este de Canadá no eran ácidos tan recientemente como hace varias décadas.
La comunidad de fitoplancton cambió notablemente durante la acidificación del lago 223 en el Área Experimental Lakes (Findlay y Kasian, 1986). Inicialmente, estuvo dominada por especies de algas pardas doradas, pero con la acidificación esta cambió a algas verdes (Chlorophyceae). Aunque la composición de las especies cambió sustancialmente, hubo poca diferencia en la diversidad de especies. Un pequeño incremento en la biomasa de algas se produjo como resultado de la acidificación, probablemente causado por el aumento de la claridad del agua, lo que permitió que se produjera una mayor productividad. Cuando se permitió que el lago 223 se volviera menos ácido, las especies de algas típicas de la comunidad de preacidificación reaparecieron rápidamente.
Sin embargo, la comunidad fitoplanctónica es mucho más sensible a la fertilidad del agua que a los cambios en su acidez, siendo especialmente sensible al fósforo (ver Capítulo 20). De hecho, la productividad de casi todas las aguas dulces aumenta si son fertilizadas con fósforo. Este cambio ecológico, conocido como eutrofización, también ocurre en cuerpos de agua ácidos. Esto es ilustrado por estudios de dos lagos adyacentes en Nueva Escocia, Little Springfield y Drain. Después de que la actividad de construcción en sus cuencas hidrográficas expusiera a la atmósfera minerales que contenían pirita, ambos lagos se volvieron altamente ácidos a través de un proceso similar al drenaje ácido-mina (Kerekes et al., 1984). Little Springfield Lake tenía un pH de 3.7 y soportaba poca productividad de algas, era oligotrófico. Sin embargo, Drain Lake (pH 4.0) recibió aguas residuales ricas en fósforo y se volvió eutrófico y altamente productivo a pesar de su acidez.
Los perifitos son algas microscópicas que viven en la superficie de sedimentos, rocas, restos leñosos y plantas acuáticas. La comunidad de perifitos puede incluir cientos de especies, incluso en lagos ácidos. Los perifitos son especialmente abundantes en lagos con aguas claras, incluyendo las ácidas, donde su biomasa a fines del verano puede desarrollar esteras turbias o parecidas a fieltros. Durante la acidificación del Lago 223, una estera bentónica del alga verde filamentosa Mougeotia se desarrolló en aguas poco profundas después de que el pH disminuyó por debajo de 5.6. Se desconocen las razones del crecimiento de las esteras de algas, pero podrían deberse a la reducción del pastoreo por parte de los invertebrados.
Plantas Acuáticas
Las plantas acuáticas (o macrófitas) pueden ser abundantes en lagos y estanques poco profundos. La acidificación de algunos lagos ha dado lugar a un incremento de musgos acuáticos, especialmente especies de Sphagnum. En algunos casos, esto estuvo acompañado de descensos de otras plantas, como caña (Phragmites communis), lobelia de agua (Lobelia dortmanna) y quillwort (Isoetes spp.). Además, la invasión por Sphagnum puede intensificar la acidificación, ya que estos musgos son altamente eficientes para absorber Ca 2+, Mg 2+ y otros cationes del agua, que intercambian por H +. Las esteras de Sphagnum también interfieren con las reacciones químicas en la interfaz sedimento/agua, lo que dificulta la neutralización de la acidez que se produce allí.
Las comunidades de plantas acuáticas difieren mucho entre lagos ácidos de agua clara y aquellos con agua teñida orgánicamente. Por ejemplo, el Lago Pebbleloggitch (Cuadro 19.5) tiene agua ácida de color marrón oscuro (pH 4.5), lo que impide la penetración de la luz en hábitats más profundos. En consecuencia, las plantas acuáticas solo pueden crecer dentro de una franja poco profunda alrededor del borde del lago, y solo el 15% del fondo está vegetado (Stewart y Freedman, 1989). Los macrófitos más abundantes, como el lirio amarillo (Nuphar variegatum), tienen hojas flotantes. En comparación, el cercano Lago Piel de Castor tiene agua extremadamente clara y prácticamente todo el fondo recibe suficiente luz para soportar plantas acuáticas, incluso a una profundidad de 6.5 m. Muchos de los macrófitos, incluyendo esteras de Sphagnum, mantienen todo su follaje bajo el agua.
Incluso en lagos ácidos, la productividad de los macrófitos es estimulada por la adición de nutrientes. Drain Lake (mencionado anteriormente) es un lago extremadamente ácido (pH 4.0) pero eutrófico, con una exuberante productividad de plantas acuáticas. Al igual que con el fitoplancton, la fertilidad del agua tiene un efecto mucho mayor en la productividad de las plantas acuáticas que la acidez.
Zooplancton
Los zooplancton son animales diminutos, en su mayoría crustáceos, que viven en la columna de agua. La mayoría de los zooplanctores se alimentan por filtración de células de fitoplancton, pero algunos son depredadores. Algunas especies son tolerantes a la acidez y pueden presentarse en agua de pH 4.0 o menos. Los efectos de la acidificación sobre el zooplancton son complejos debido a que intervienen varios factores:
- la toxicidad de H + y metales, como Al 3+
- cambios en la disponibilidad del fitoplancton como alimento
- cambios en la depredación, especialmente si se eliminan los peces que comen zooplancton
Una encuesta de 47 lagos en Ontario encontró que ciertos zooplancton son buenos indicadores de la química del agua (Sprules, 1975). Las especies indicadoras de lagos ácidos con pH < 5.0 fueron Daphnia catawba, D. pulicaria y Polyphemus pediculus. Otros ocurrieron solo a pH > 5.0: Daphnia ambigua, D. galeata mendotae, D. longiremis, D. retrocurva, Diaptomus oregonensis, Epischura lacustris, Leptodora kindtii y Tropocyclops prasinus mexicanus . Sin embargo, algunos zooplancters fueron indiferentes a la acidez y ocurrieron en un amplio rango de pH. Por ejemplo, Diaptomus minutus fue la especie más frecuentemente observada, ocurriendo sobre pH 3.8 a 7.0. Los lagos ácidos tenían una comunidad algo depauperada de zooplancters; aquellos con pH < 5.0 had 1-7 species with only one or two dominant being dominant, while lakes with a pH > 5.0 tenían 9-16 especies con tres o cuatro siendo dominantes.
La acidificación experimental del lago 223 resultó en una mayor abundancia de zooplancton, efecto que se atribuyó a un incremento en su alimento de biomasa de fitoplancton (Malley et al., 1982). A lo largo de la acidificación, Diaptomus minutus y Cyclops bicuspidatus siguieron siendo los zooplancteros más abundantes, pero algunas otras especies fueron intolerantes. Esto incluyó al camarón zarigüeya (Mysis relicta), un gran depredador que desapareció cuando el pH disminuyó por debajo de 5.6.
Invertebrados bentónicos
Los invertebrados bentónicos viven sobre o en el sedimento de cuerpos de agua. El número de especies tiende a ser menor en aguas ácidas, pero aún pueden ser abundantes, especialmente los peces depredadores han desaparecido. Los invertebrados bentónicos más comunes en lagos ácidos son especies de insectos y crustáceos (aunque otras especies de estos grupos son intolerantes a la acidez). Los moluscos no se presentan en condiciones fuertemente ácidas porque les resulta difícil mantener su caparazón de carbonato de calcio. Un estudio de más de mil lagos en Noruega encontró que ninguna especie de almejas podría tolerar un pH por debajo de 6.0, y ningún caracoles por debajo de 5.2 (Okland y Okland, 1986).
Debido a que el sedimento está más fuertemente tamponado que su agua suprayacente, es mucho menos vulnerable a la acidificación. Por ejemplo, la acidez del sedimento no cambió mucho durante la acidificación experimental del lago 223 (Kelly et al., 1984). Cuando el pH del agua justo por encima del sedimento fue 5.3, a 0.5 cm en el sedimento fue 6.0, y a 2.0 cm fue 6.7, sin cambios desde la condición de preacidificación. Debido a que el hábitat de los invertebrados bentónicos está bien amortiguado, algunos de ellos no se ven muy afectados por la acidificación del agua del lago suprayacente. Durante la acidificación del lago 223, la abundancia de jejenes quironómidos aumentó y alcanzó su punto máximo a un pH de agua de aproximadamente 5.6 (Mills, 1984). Sin embargo, las larvas inicialmente abundantes de mayfly desaparecieron a pH 5.0, y el cangrejo de río Orconectes virilis se extirpó debido al fracaso reproductivo después de que el pH cayera por debajo de 5.6.
Pescado
Las poblaciones de peces son las víctimas más conocidas de la acidificación. Muchas pérdidas de trucha, salmón y otros peces de importancia económica han ocurrido en aguas acidificadas en Canadá, Estados Unidos y Eurasia.
Estudios realizados en Ontario han documentado la pérdida de poblaciones de peces de lagos acidificados en la región de Killarney (Beamish y Harvey, 1972; Harvey y Lee, 1982). Esa área está sujeta a precipitación severamente ácida (pH 4.0-4.5) y a deposición en seco de SO 2 acidificante debido a su proximidad a las fundiciones en Sudbury. Una encuesta realizada en la década de 1970 encontró que 33 de los 150 lagos en el área de Killarney tenían un pH por debajo de 4.5. Estos ecologistas en realidad monitorearon la extirpación local de varios peces en Lumsden y George Lakes. También hubo evidencia anecdótica de pérdidas de otras poblaciones, debido a que la población local tenía un recuerdo de las pesquerías deportivas históricas en lagos actualmente sin peces. El área de Killarney ha tenido 17 extirpaciones de trucha de lago (Salvelinus namaycush), un importante pez deportivo que no puede reproducirse a pH <5.5. También hay extirpaciones de lubina bocazas (Micropterus dolomieiu) de 12 lagos, de perca americana (M. salmoides) y lucioperca (Stizostedion vitreum) de cuatro lagos, y perca amarilla (Perca flavescens) y lubina (Ambloplites rupestris) de dos lagos.
El lago Lumsden se acidificó de pH 6.8 en 1961 a 4.4 en 1971. Esa acidificación resultó en un fracaso reproductivo y extirpación de trucha de lago, arenque de lago (Coregonus artedii) y lechón blanco (Catostomus commersoni). Cuando George Lake alcanzó pH 4.8-5.3, desaparecieron la trucha de lago, la lucioperca, la lota (Lota lota) y la lubina de boca pequeña. A medida que avanzaba la acidificación, hubo pérdidas de lucio norteño (Esox lucius), lubina, pez sol de calabaza (Lepomis gibbosus), cabeza de toro marrón (Ictalurus nebulosus) y lechón blanco. Estas extirpaciones fueron el resultado de fallas persistentes de estos peces para reproducirse en lagos acidificados.
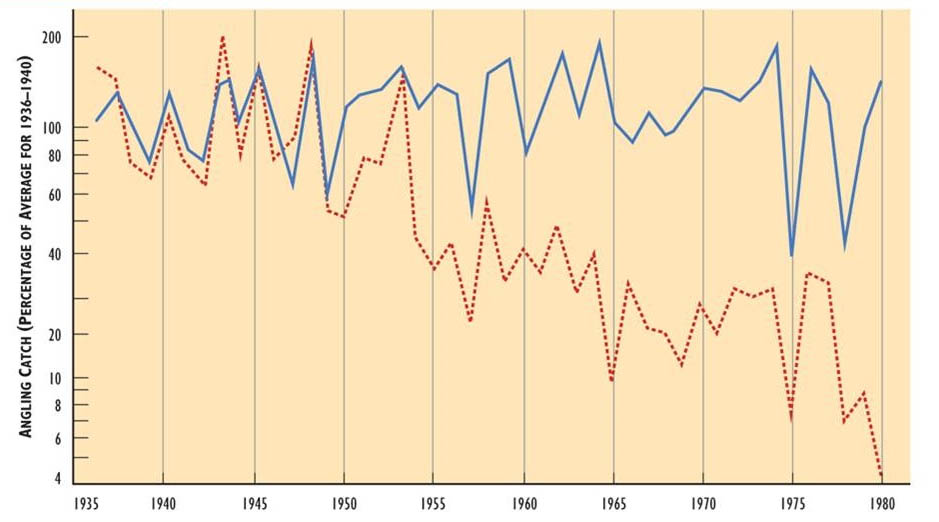
También se han producido pérdidas de poblaciones de peces deportivos en Nueva Escocia, donde el salmón del Atlántico (Salmo salar) se ha perdido de ríos ácidos (pH por debajo de 4.7), pero no de aquellos con pH más alto (Figura 19.4). Lacroix y Townsend (1987) escribieron salmón juvenil en cuatro corrientes ácidas en Nueva Escocia; ninguno sobrevivió en pH por debajo de 4.7, pero todos lo hicieron a pH más altos.
En otros lugares, las primeras encuestas (de la década de 1930) en las montañas Adirondack del estado de Nueva York encontraron que la trucha de arroyo (Salvelinus fontinalis) estaba presente en 82% de los lagos. Sin embargo, en la década de 1970, esa especie estuvo ausente en 43% de 215 lagos de la misma región (Schofield, 1982).
Un extenso estudio de 700 lagos noruegos en la década de 1970 encontró que la trucha marrón (Salmo trutta) estaba ausente del 40% de los cuerpos de agua y escasa en otro 40% (Wright y Snekvik, 1978). Casi todos esos lagos habían soportado truchas antes de la década de 1950. La extirpación de las poblaciones de truchas fue más extensa en el sur de Noruega, donde la deposición acidificante es más intensa.
En el este de América del Norte, los peces que son más tolerantes a la acidificación son la perca amarilla, la lubina, el minnow central (Umbra limni), la perca americana, la aleta azul (Lepomis macrochirus), el bullhead negro (Ictalurus melas), el bullhead marrón, el brillo dorado (Notemigonus crysoleucas) y la anguila americana (Anguilla rostrata). Estas especies se presentan en algunos cuerpos de agua con pH más ácido que 4.6. Otras especies son más sensibles a la acidificación y generalmente necesitan un pH >6.0 para sobrevivir.
Previo a su acidificación experimental, el lago 223 soportaba trucha de lago, lechón blanco, pececillo cabeza roja (Pimephales promelas), dace perlado (Semotilus margarita) y esculpina babosa (Cottus cognatus) (Mills et al., 1987). El pececillo fathead fue más sensible a la acidificación, y disminuyó rápidamente cuando el pH alcanzó 5.6. El fracaso reproductivo de la trucha lacustre comenzó a pH 5.4 y del lechón blanco a pH 5.1, lo que resultó en una disminución de la población a medida que los peces mayores murieron
En general, las etapas de historia de vida más jóvenes (alevines y juveniles) son más sensibles a la acidez que los peces adultos. Es por ello que la mayoría de las pérdidas de poblaciones se atribuyen al fracaso reproductivo más que a la mortalidad de los adultos. Sin embargo, hay muchas observaciones de peces adultos muertos por la exposición a eventos de choque ácido durante el deshielo de la primavera.
A medida que las aguas superficiales se acidifican, aumenta la concentración de metales disueltos, especialmente de Al 3+ y AlOH 2+, que son iones tóxicos del aluminio. En muchas aguas ácidas, la toxicidad del aluminio es suficiente para matar peces, independientemente de cualquier efecto directo del H +. En general, la supervivencia y crecimiento de larvas de peces y etapas de historia de vida más antiguas se reducen cuando la concentración de aluminio iónico disuelto supera 0.1 ppm, una exposición que es común en aguas ácidas. En el agua de color marrón, sin embargo, casi todo el aluminio disuelto y otros metales están presentes como complejos organometálicos. Los metales en ese estado son mucho menos tóxicos que las formas iónicas libres que ocurren en aguas claras con una acidez similar.
Anfibios
Los anfibios dependen del hábitat acuático durante al menos parte de su ciclo de vida. La mayoría de las especies canadienses ponen sus huevos en el agua, donde habitan sus larvas hasta que ocurre la metamorfosis, después de lo cual los adultos utilizan hábitat terrestre cercano. Las investigaciones sugieren que algunas especies de anfibios son vulnerables a la acidificación de su hábitat acuático, mientras que otras parecen indiferentes.
Un estudio de criaderos de anfibios en Nueva Escocia, cubriendo un rango de pH de 3.9 a 9.0, encontró que algunas especies no estaban obviamente influenciadas por la acidez (Dale et al., 1985):
- la rana toro (Rana catesbeiana) ocurrió de pH 4.0 a 9.0
- mirón primaveral (Hyla crucifer) y salamandra manchada amarilla (Ambystoma maculatum) de pH 3.9 a 7.8
- rana verde (R. clamitans) de pH 3.9 a 7.3
- y rana de madera (R. sylvatica), de pH 4.3 a 7.8.
La salamandra manchada amarilla y las ranas verdes, toro, madera y pickerel (R. palustris) tenían huevos, larvas en desarrollo y adultos presentes en algunos hábitats a pH 4.0, lo que sugiere que la reproducción se estaba produciendo a esa acidez extrema. Estudios realizados en otras regiones, sin embargo, han demostrado que algunas especies de anfibios son intolerantes a la acidez.
Los experimentos de laboratorio con 14 especies de anfibios encontraron que exponer huevos a pH 3.7-3.9 causó más de 85% de mortalidad embrionaria, mientras que la exposición prolongada a pH 4.0 provocó una tasa de mortalidad > 50% (Freda et al., 1991). Hay que tener en cuenta, sin embargo, que un pH acuático tan ácido como 4.0 es poco común en la naturaleza. Además, tales condiciones ácidas suelen estar asociadas con el drenaje ácido-mina o los pantanos naturales, más que con la acidificación causada por la deposición atmosférica (que tiene un umbral de acidificación de aproximadamente pH 4.5 o superior). En general, parece que la mayoría de las especies de anfibios son menos vulnerables que los peces a sufrir disminuciones poblacionales causadas por la acidificación.
Aves Acuáticas
Los efectos directamente tóxicos de la acidificación en las aves acuáticas y otras aves acuáticas no han sido documentados y probablemente no ocurren. Sin embargo, la acidificación hace que los hábitats acuáticos cambien, y esto tiene consecuencias indirectas para las poblaciones de aves. Por ejemplo, si la acidificación elimina poblaciones de peces más pequeños, entonces las aves acuáticas comedoras de peces como el colirio común (Gavia immer) y el merganser (Mergus merganser) sufrirán, al igual que las rapaces piscivoras como el águila pescadora (Pandion haliaetus). Al mismo tiempo, sin embargo, la extirpación de peces depredadores podría resultar en una mayor abundancia de insectos acuáticos y zooplancton, lo que mejora el recurso alimentario para otras aves acuáticas, como el ánade real (Anas platyrhynchos), el pato negro (A. rubripes), el pato de cuello anillado (Aythya collaris) y el ojo dorado (Bucephala clangula).
Se estudió el éxito reproductivo de los lomos comunes en 84 lagos de Ontario (Alvo et al., 1988). Solo 9% de los intentos de reproducción tuvieron éxito en lagos de baja alcalinidad (< 40 µEq/L), los cuales son ácidos o vulnerables a la acidificación. En contraste, 57% de los intentos de reproducción tuvieron éxito en lagos con alcalinidad de 40-200 µEq/L, y 59% si > 200 µEq/L, estas observaciones probablemente reflejan el tamaño de las poblaciones de peces en estos lagos.
Un estudio de 79 pequeños lagos y estanques en New Brunswick encontró una mayor biomasa de invertebrados acuáticos en la zona litoral (poco profunda, cercana a la costa) en cuerpos de agua ácidos con pH 4.5-4.9 que en aquellos con pH >5.5 (Parker et al., 1992). Cinco especies de patos que se alimentan de invertebrados tuvieron un promedio de 3.5 crias/ha en cuerpos de agua con pH 5.5, en comparación con 0.65 crias/ha a pH más altos. La mayor biomasa de invertebrados en los cuerpos de agua ácidos probablemente se debió a la disminución de la depredación debido a una menor comunidad de peces.
El lago Drain en Nueva Escocia fue descrito previamente como un lago altamente ácido (pH 4.0) pero eutrófico. Drain Lake no tiene peces pero tiene grandes poblaciones de invertebrados acuáticos y plantas. Este hábitat permite que los patos negros y los patos de cuello anular sean más productivos de lo que es típico para los lagos de la región (Kerekes et al., 1984).
Reclamación
Incluso antes de que la acidificación se convirtiera en un tema de alto perfil, los administradores de vida silvestre en algunas regiones estaban “mejorando” el hábitat de los peces deportivos en lagos de color marrón al tratar el agua ácida con piedra caliza en polvo (carbonato de calcio, CaCo 3) o cal (hidróxido de calcio, Ca (OH) 2). Estos tratamientos, conocidos como encalado, sirven para reducir la acidez, aclarar el agua y mejorar la productividad de peces como la trucha. No es sorprendente que también se hayan realizado investigaciones considerables sobre el uso de tratamientos de encalado para mejorar la condición de lagos y otras aguas superficiales que han sido acidificadas por deposición atmosférica.
Los efectos del encalado sobre el pH se ilustran en la Figura 19.5 para tres lagos encalados y un lago de referencia (no encalado pero ácido) en Ontario (Dillon et al., 1979; Yan et al., 1979). Inicialmente, los lagos tratados tenían un pH de 4.0-5.0, pero este se incrementó a pH 7.0-8.0 por el tratamiento de encalado de lago completo. Middle y Hannah Lakes tuvieron un pH bastante estable después del tratamiento, pero Lohi rápidamente volvió a una condición ácida. Esta diferencia refleja los tamaños de las cuencas hidrográficas de los lagos: Lohi drena un área relativamente grande y se enrolla rápidamente, por lo que sus resultados de neutralización son de menor duración. Obsérvese que fertilizar los lagos con fosfato, que estimula la productividad del fitoplancton, también tiene un efecto neutralizante de ácidos, aunque es mucho menor que lo que resultó del encalado.
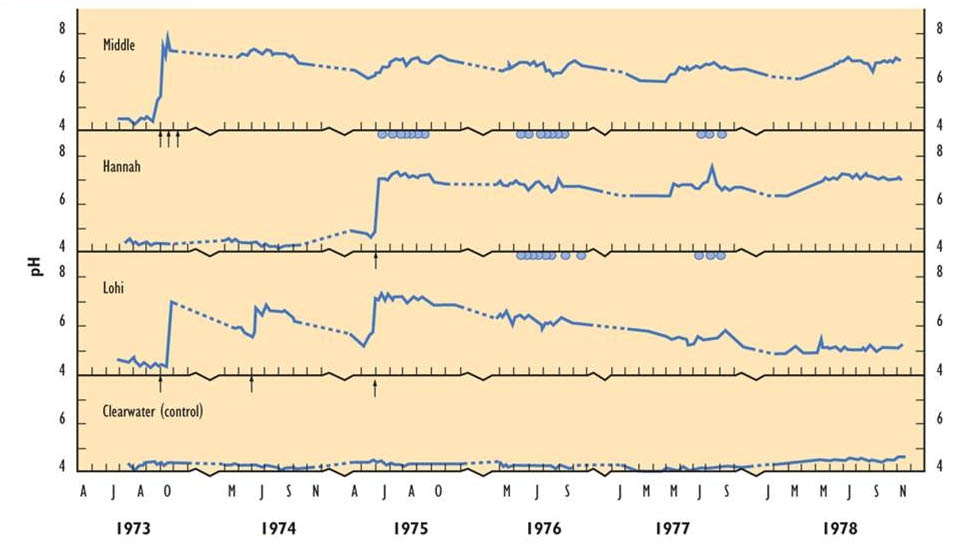
Inicialmente, los lagos tratados tuvieron una gran disminución en la productividad del fitoplancton y zooplancton. Sin embargo, la biomasa del fitoplancton pronto volvió a la condición de pre-encalado, pero con cambios persistentes en la composición de las especies. El zooplancton se recuperó más lentamente, e incluso después de tres años no había regresado a la abundancia pre-encalada. Además, los peces mantenidos en jaulas en los lagos encalados sufrieron altas tasas de mortalidad. Esto probablemente se debió a la toxicidad de los metales, debido a que los lagos se habían visto afectados por las consecuencias de las fundiciones de Sudbury. Aunque las concentraciones acuosas de Al, Cu, Ni y Zn disminuyeron después del encalado, debido a que su solubilidad es mayor en el agua ácida, aún se mantuvieron lo suficientemente altas como para estresar a los peces y otras biotas.
En algunas regiones de Escandinavia, el encalado se utiliza rutinariamente para tratar grandes cantidades de lagos y ríos acidificados. Esto se hace para mitigar los daños causados por la acidificación, especialmente a las poblaciones de peces. Suecia, por ejemplo, tiene los programas de encalado más grandes del mundo (Stensdotter et al., 2005). A finales de la década de 1970, alrededor de 17 mil lagos en Suecia se habían acidificado por deposición atmosférica (de un total de 90 mil lagos), al igual que muchos arroyos y ríos. De los cuerpos de agua acidificados, más de 7,500 lagos y 14,000 km de agua corriente están siendo tratados con agentes de encalado; cada año se utilizan alrededor de 200 mil toneladas de piedra caliza en polvo. Por lo general, el tratamiento de encalado debe repetirse en una rotación de tres años. En Noruega, se han encalado cerca de 3 mil cuerpos de agua (State of the Environment Norway, 2008). El encalado se ha realizado mucho menos extensamente en América del Norte, en gran parte porque los programas son caros y las prioridades ambientales son diferentes a las de Escandinavia.
Investigaciones sobre encalado han demostrado que las aguas superficiales acidificadas pueden ser neutralizadas. Sin embargo, debe entenderse que el encalado trata los síntomas de daño en los ecosistemas acidificados, pero no las causas de la acidificación. Además, el encalado en sí mismo representa un estrés ambiental que transforma una masa de agua de una condición contaminada a otra que aún está dañada, pero menos tóxica. El encalado provoca un gran cambio en los ecosistemas adaptados al ácido, seguido de cambios en la abundancia de especies a medida que se desarrollan nuevas comunidades. En general, el beneficio más importante del encalado es que las aguas menos ácidas pueden soportar peces, mientras que las aguas ácidas no pueden. Sin embargo, el encalado no es una solución a largo plazo para la acidificación de las aguas dulces. En parte, esto se debe a que los cuerpos de agua deben volver a tratarse periódicamente a medida que los materiales de encalado se consumen o se descargan del sistema.
Hasta cierto punto, los cuerpos de agua acidificados también pueden manejarse tratándolos con fertilizante para estimular su productividad, como se examinó previamente para Drain Lake. Los lagos ácidos fertilizados pueden sostener una gran biomasa de fitoplancton, macrófitos e invertebrados. Las aves acuáticas pueden prosperar en este hábitat, incluso si los peces no pueden ser sostenidos debido a las condiciones ácidas. Sin embargo, no es necesariamente apropiado crear grandes cantidades de lagos altamente productivos. Por ejemplo, donde la natación recreativa es una actividad importante, las abundantes algas y macrófitas se consideran una molestia.

Reducción de emisiones
En última instancia, el extenso daño causado por la deposición acidificante de la atmósfera solo puede resolverse reduciendo las emisiones de gases formadores de ácido. Si bien este hecho es intuitivamente claro, el tema de la reducción de emisiones sigue siendo polémico por las siguientes razones:
- Los científicos no saben exactamente cuánto deben reducirse las emisiones de SO 2 y/o NO x para evitar daños al acidificar la deposición.
- Diversas estrategias de reducción de emisiones son posibles, y varían en sus consecuencias económicas. ¿Sería más efectivo apuntar a grandes fuentes puntuales de emisiones, como centrales eléctricas y fundiciones, al tiempo que se presta menos atención a fuentes más pequeñas pero numerosas, como automóviles y hornos domésticos que queman petróleo? ¿O deberían reducirse agresivamente tanto las fuentes grandes como las pequeñas?
- Para que sean efectivas, las reducciones de emisiones deben coordinarse entre los países vecinos. Por ejemplo, ¿qué pasaría si el gobierno de un país (quizás con grandes emisiones de SO 2 y NO x) no considera que la deposición acidificante sea un problema de alta prioridad, pero los países vecinos sí?
No es sorprendente que las industrias y regiones responsables de grandes emisiones de gases formadores de ácido hayan tendido a resistir la imposición de reducciones sustanciales legisladas de sus liberaciones. En general, argumentan que la justificación científica de las reducciones aún no es convincente, mientras que se sabe que los costos de los controles son grandes y potencialmente disruptivos para la economía.
Además, ¿qué tan bajas deben ser las tasas de deposición atmosférica de compuestos de azufre y nitrógeno, para evitar una mayor acidificación de las aguas superficiales sensibles o para permitir su recuperación? Las tasas críticas de deposición de compuestos acidificantes están influenciadas, en parte, por la vulnerabilidad de los ecosistemas receptores; las áreas con suelos poco profundos y pobres en nutrientes pueden sostener insumos mucho más bajos de sustancias acidificantes que las áreas ricas en calcio. Se considera que los lagos altamente sensibles en el este de Canadá tienen umbrales de carga crítica de <20 meq/ha•y de deposición de azufre y nitrógeno (Figura 19.6).
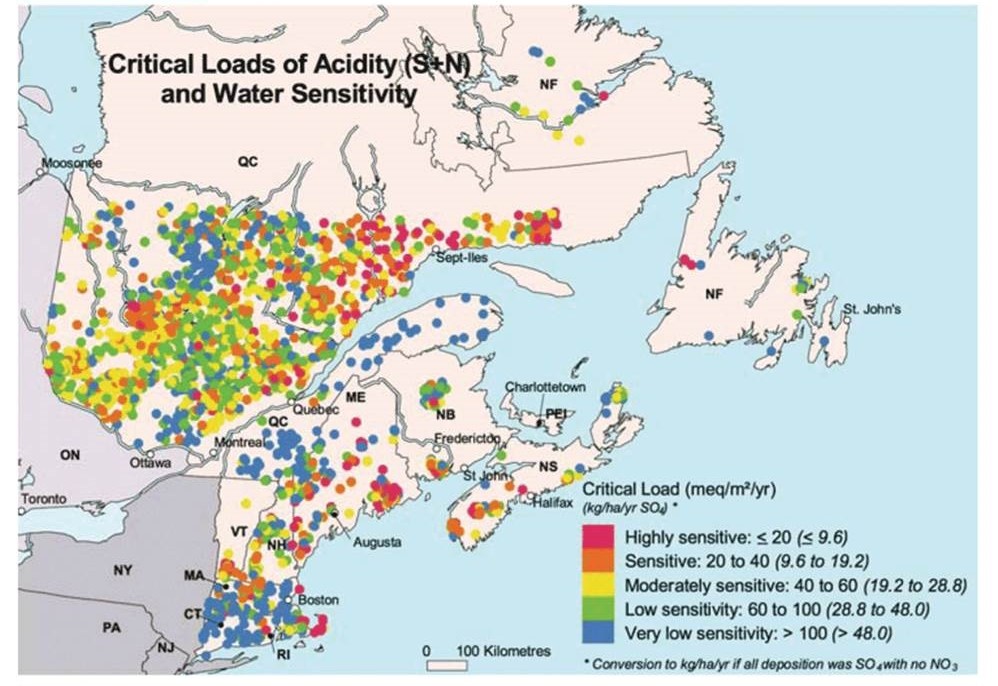
Si bien existen muchas incertidumbres sobre las causas específicas y la magnitud de los daños causados por la deposición atmosférica de sustancias acidificantes, es obvio que lo que sube (emisiones de gases precursores de ácido) eventualmente debe bajar (como deposición acidificante). Esta idea de sentido común está respaldada por una gran cantidad de evidencia científica. Este conocimiento, combinado con la conciencia pública y la preocupación por la acidificación en muchos países, ha estimulado a los políticos a comenzar a tomar medidas efectivas. Esto está resultando en una reducción de las emisiones de SO 2 y NO x, particularmente en países relativamente ricos de América del Norte y Europa Occidental.
En 1992, los gobiernos de Canadá y Estados Unidos firmaron un tratado binacional destinado a reducir la deposición acidificante en ambos países. Este acuerdo, conocido como el Acuerdo de Calidad del Aire Canadá-Estados Unidos, contempla grandes gastos por parte de industrias y gobiernos para reducir sustancialmente las emisiones de contaminantes atmosféricos, especialmente SO 2. Estos recortes se suman a las reducciones de emisiones que ambos países ya habían logrado durante la década de 1980. En Estados Unidos, las emisiones de SO 2 han disminuido de 23.1 Mt en 1980 a 16.9 Mt en 1995 y a 6.0 Mt en 2011, mientras que las emisiones de NO x aumentaron ligeramente de 20.7 Mt en 1980 a 21.8 Mt en 1995 y luego disminuyeron a 13.6 Mt en 2011 (EPA, 2014; véase también el Cuadro 16.2). A modo de comparación, las emisiones canadienses de SO 2 disminuyeron de 4.7 Mt en 1980 a 2.5 Mt en 1995 y a 1.3 Mt en 2012, mientras que las emisiones de NO x se mantuvieron aproximadamente iguales durante 1980 a 1995 en 2.4—2.6 Mt/a, y luego disminuyeron a 1.9 Tm/a en 2012 (Environment Canada, 2014).

Un componente importante de las iniciativas de Estados Unidos para reducir las emisiones de SO 2, establecidas bajo las Enmiendas a la Ley de Aire Limpio de 1990, es la creación de un mercado para el comercio de emisiones. En esencia, cualquier empresa que esté emitiendo SO 2 a una tasa inferior a la permitida por la Agencia de Protección Ambiental (EPA) tiene derecho a vender (o comerciar) esos “créditos” no utilizados a otro negocio que esté superando su objetivo de emisiones. Esta es una iniciativa importante porque ayuda a establecer un “valor de mercado” para las emisiones de ciertos contaminantes, y también para las inversiones para reducir su liberación. Desde la perspectiva ambiental, este mercado de emisiones es un instrumento lógico porque la atmósfera es un recurso de propiedad común que es propiedad y es afectado por todos, por lo que cualquier cambio en la liberación de contaminantes (ya sea que aumente o disminuya) tiene un efecto global. En esencia, una empresa cuyas emisiones son menores a su asignación puede obtener una ganancia vendiendo sus créditos, mientras que otra que haya superado su objetivo incurre en costos. Esos costos pueden ser pagados ya sea mediante la compra de créditos de emisiones o tomando medidas para reducir las emisiones, como instalar la tecnología de remoción SO 2, cambiar a un combustible bajo en azufre o, en casos extremos, cerrar instalaciones particularmente sucias.
La flexibilidad asociada a estas opciones es considerada por muchos economistas y políticos como un beneficio importante del sistema de comercio de derechos de emisión. Sin embargo, el establecimiento de un mercado que mercantilice la liberación de SO 2 libera a muchas empresas de las costosas inversiones que se requerirían para lograr reducciones tangibles de sus emisiones. Este hecho ha generado polémica, al igual que el posible establecimiento de un mercado global para las emisiones negociables de gases de efecto invernadero bajo el Protocolo de Kyoto (Capítulo 17).
En cualquier caso, ¿los recortes en las emisiones son lo suficientemente grandes como para lograr su efecto pretendido de prevenir y reparar la acidificación de los ecosistemas? Según una evaluación científica realizada por Environment Canada, las reducciones de las emisiones de SO 2 han dado como resultado menores tasas de deposición acidificante en Canadá (basado en una comparación de datos de 1990—1994 y 1996—2000; Environment Canada, 2005). Sin embargo, se estima que el 21-75% del este de Canadá aún recibe cantidades de deposición acidificante que exceden las cargas críticas (los números menores corresponden al mejor de los casos, y el mayor al peor de los casos). Environment Canada también sugiere que, para proteger los ecosistemas de mayores daños causados por la deposición acidificante, Canadá y Estados Unidos requerirán una reducción adicional del 75% de las emisiones de SO 2 más allá de las acordadas bajo el Acuerdo de Calidad del Aire existente. Una conclusión similar fue alcanzada por la Agencia de Protección Ambiental de Estados Unidos en su propia evaluación científica del tema (2011).
Además, no se han tomado muchas medidas para reducir las emisiones de NO x, y esto parece estar trabajando en contra de los beneficios ambientales asociados con un mayor control del SO 2. Es crucial que las futuras acciones regulatorias incluyan la reducción de las emisiones tanto de SO 2 como de NO x y que se siga monitoreando la lluvia ácida y sus daños ambientales.
El tratado de contaminación del aire de 1992 entre Canadá y Estados Unidos es un logro útil. Si bien ha habido reducciones en la acidez de las precipitaciones y las aguas superficiales en algunas zonas, parece que las reducciones de las emisiones de SO 2 no son lo suficientemente grandes como para mitigar completamente muchos de los daños causados por la deposición acidificante. Hasta el momento, áreas extremadamente grandes del terreno continúan siendo afectadas por la acidificación causada por la deposición atmosférica.
En la Figura 19.7 se muestran las tendencias de mejora en la química de la precipitación y el agua de arroyo Hubbard, NH, un lugar de monitoreo con datos sobresalientes a largo plazo de este tipo de datos. Los datos de precipitación muestran que la acidez de la precipitación está disminuyendo (el pH va en aumento), y que las concentraciones de sulfato y nitrato también están disminuyendo. La reducción de las concentraciones de sulfato es especialmente grande, y probablemente refleja el hecho de que los controles regulatorios se han concentrado en las emisiones de SO 2 (el principal precursor del sulfato) más que en NO x (los precusores de nitrato). Los datos de aguas fluviales también muestran una disminución de la acidez y la concentración de sulfato, así como una disminución constante en las concentraciones de calcio. Esta última observación puede reflejar una pérdida progresiva de calcio de estas cuencas hidrográficas, lo que representa una degradación de la capacidad del sistema para proporcionar capacidad de neutralización de ácidos frente a futuros insumos de sustancias acidificantes. John Smol (2008) de Queen's University se refiere al fenómeno de las pérdidas progresivas de calcio como una especie de “osteoporosis” que afecta y degrada muchas cuencas hidrográficas cuyo suelo y lecho rocoso son bajos en calcio.
Algunos lagos también se están beneficiando de la reducción de la carga de sulfato. Una encuesta de 202 lagos monitoreados en el este de Canadá desde principios de la década de 1980 encontró que la acidez de 33% había disminuido, mientras que 56% se mantuvieron sin cambios, y 11% se volvió más ácida (Environment Canada, 1998. En general, alrededor del 80% de los lagos recientemente muestreados en Nueva Escocia tenían un pH <6.0, al igual que 40% de los de Ontario y 25% en New Brunswick (nótese que el pH <6.0 se considera un umbral crítico de tolerancia para peces sensibles y otros animales acuáticos; Environment Canada, 2005). Muchos de estos lagos son naturalmente ácidos debido a las sustancias orgánicas que se lixivia de los pantanos, particularmente en Nueva Escocia, donde las aguas marrones comprenden alrededor del 40% de los lagos ácidos. En todo el este de Canadá, sin embargo, se cree que 0.5-0.6 millones de lagos siguen siendo vulnerables a la acidificación bajo un régimen de depósito atmosférico similar al de los últimos años.
Hay que reconocer que el control de la contaminación es sumamente caro. Por ejemplo, podría costar 600 millones de dólares anuales para reducir aún más las emisiones de SO 2 en un 50% por debajo de los objetivos actuales para el este de Canadá y el este de Estados Unidos. Debido a este costo, las políticas que favorecen la reducción de emisiones de SO 2 y NO x pueden no ser capaces de sobrevivir a los frecuentes desafíos que montan políticos, economistas y empresarios que no creen que tales acciones sean necesarias.
Hasta el momento, las acciones para reducir las emisiones de SO 2 y NO x han sido vigorosas sólo en regiones relativamente ricas de América del Norte y Europa Occidental. En los países menos ricos, el foco político se centra principalmente en el crecimiento industrial y económico. Sin embargo, la contaminación del aire y otros daños ambientales “subsidian” ese crecimiento económico y a menudo se les presta poca atención. A la brevedad posible, se debe dedicar mucha más atención política y científica a los problemas de acidificación de la deposición y otros tipos de contaminación en Europa del Este, Rusia, China, India, el sudeste asiático, México y otras economías de rápido crecimiento. En esos países, las emisiones de SO 2, NO x y otros contaminantes importantes transportados por el aire están galopando fuera de control.
Conclusiones
La acidificación es un proceso natural que ocurre a medida que los ecosistemas interactúan con influencias climáticas y biológicas, por ejemplo en pantanos y bosques de coníferas. La acidificación también es causada por influencias antropogénicas, particularmente las emisiones de SO 2 y NO x, que se oxidan para formar ácidos mientras están en la atmósfera o después de que se depositan en seco en los ecosistemas. Los ecosistemas acuáticos y terrestres que son vulnerables a la acidificación tienen poca capacidad de neutralización de ácidos, en gran parte debido a pequeñas cantidades de carbonatos de calcio y magnesio en su suelo, sedimento o rocas. Las aguas dulces de baja alcalinidad están particularmente en riesgo de acidificación por deposición atmosférica. Cuando un cuerpo de agua se acidifica a un pH inferior a aproximadamente 6.0, comienza a perder sus poblaciones de especies de peces vulnerables y otra biota sensible. Las influencias acidificantes también dañan el ambiente construido al erosionar materiales hechos de piedra caliza, mármol y ciertos metales como el cobre. Si bien algunos de los daños ecológicos causados por la acidificación de las aguas superficiales pueden mitigarse mediante el encalado, este tratamiento tiene que repetirse, típicamente en una rotación de aproximadamente tres años. La mejor manera de evitar los problemas ambientales asociados con la deposición acidificante es reducir las emisiones de los gases precursores de ácido clave (SO 2 y NO x). En grado sustancial, esto se está haciendo en países ricos, entre ellos Canadá. Sin embargo, economías de rápido crecimiento, como China e India, no están prestando mucha atención a este problema ambiental, y está empeorando rápidamente a medida que incrementan agresivamente su suministro de energía comercial al quemar combustibles fósiles sulfurosos, particularmente carbón.
Preguntas para revisión
- ¿Explicar el principio de conservación de la neutralidad electroquímica? ¿Cómo es relevante para la química de la precipitación y las aguas superficiales?
- ¿Qué influencias ambientales hacen que el suelo se vuelva ácido? ¿Cómo se puede mitigar este problema?
- ¿Cómo afecta la acidificación del hábitat de agua dulce a la biota acuática, incluyendo fitoplancton, macrófitos, zooplancton, invertebrados bentónicos, peces y aves?
- Definir la carga crítica y explicar los factores que influyen en su valor para tipos particulares de terreno y aguas superficiales.
Preguntas para Discusión
- Comparar la química del agua de lluvia y agua de lago en una región vulnerable a la acidificación. ¿Cuáles son las razones de las diferencias?
- ¿Cómo contribuyen a la acidificación las deposiciones húmedas y secas de sustancias acidificantes? ¿Por qué difieren sus tasas e importancia relativa entre las zonas urbanas y rurales?
- ¿Las aguas superficiales de la zona donde vives son ácidas o es probable que se vuelvan así? Explica tu respuesta en términos de factores del terreno que influyen en la vulnerabilidad a la acidificación.
- Explique por qué los países ricos han estado tomando medidas para reducir sus emisiones de gases precursores ácidos, pero las economías de rápido crecimiento como China e India no lo han hecho. ¿Cuáles son las consecuencias probables de estas políticas?
Explorando problemas
- Existen dos amplias opciones para hacer frente a la deposición acidificante: (1) reducción de emisiones para prevenir el problema y (2) encalado de agua y suelo para tratar los síntomas. Algunas personas han llamado a las reducciones de emisiones la “solución de mil millones de dólares” y a la “solución del millón de dólares”. Esto se debe a los costos de capital potencialmente mayores asociados a las tecnologías para reducir las emisiones de SO 2 y NO x. ¿Cuál de estas opciones (o ambas) cree que es la más adecuada para hacer frente a la acidificación como problema ambiental? Explica tu respuesta.
- Canadá y Estados Unidos han negociado un tratado relativo a los movimientos transfronterizos de contaminantes atmosféricos, con un enfoque en acidificar la deposición de la atmósfera. Los principales aspectos del tratado son las reducciones en las emisiones de SO 2, y en menor grado, NO x a la atmósfera. Usted es un científico que trabaja para Environment Canada y se le ha dado la responsabilidad de monitorear si las reducciones de emisiones negociadas han tenido éxito en mejorar las condiciones en la provincia donde vive — ¿la acidificación se está convirtiendo en un problema menor? ¿Cómo diseñarías un programa de monitoreo e investigación ambiental para responder a esta importante pregunta? ¿Qué cuestiones ecológicas y de salud humana examinarías?
Referencias citadas y lecturas adicionales
Alvo, R., D.J.J. Hussell, y M. Berrill. 1988. El éxito reproductivo de los somorros comunes (Gavia immer) en relación con la alcalinidad y otras características del lago en Ontario. Revista Canadiense de Zoología, 66:746-752.
Baker, L.A., A.T. Herlihy, P.R., Kaufmann, y J.M. Eilers. 1991. Lagos y arroyos ácidos en Estados Unidos: El papel de la deposición ácida. Ciencia, 252:1151-1154. Beamish, R.J. y H.H. Harvey. 1972. Acidificación de los lagos de montaña La Cloche, Ontario, y mortalidad resultante de peces. Revista de la Junta de Investigación Pesquera de Canadá, 29:1131-1143.
Marca, D.G., P. Kehoe, y M. Connors. 1986. La forestación conífera conduce a la acidificación del suelo en el centro de Ontario. Revista Canadiense de Investigación Forestal, 16:1289-1391.
Brodin, Y.W. y J.C.I. Kuylenstierna. 1992. Acidificación y cargas críticas en países nórdicos: antecedentes. Ambio, 21:332-338.
Buso, D.C., G.E. Likens, y J.S. Eaton. 2000. Química de la precipitación, aguas de arroyo y aguas de lago en el estudio de ecosistemas Hubbard Brook. Informe Técnico General NE-275, Departamento de Agricultura de Estados Unidos, Estación Experimental Forestal Noreste, Newtown Square, PA.
Chan, W.S., R.J. Vet, C.U. Ro, A.J.S. Tang, y M.A. Lusis. 1984. Calidad de precipitación a largo plazo y deposición húmeda en la cuenca Sudbury. Ambiente Atmosférico, 18:1175-1188.
Crocker, R.L. y J. Major. 1955. Desarrollo del suelo en relación con la vegetación y edad superficial en Glacier Bay, Alaska. Revista de Ecología, 43:427-448.
Dale, J.M., B. Freedman, y J. Kerekes. 1985. Acidez y química asociada del agua de hábitats de anfibios en Nueva Escocia. Revista Canadiense de Zoología, 63:97-105.
Dillon, P.J., D.S. Jefferies, W. Snyder, R. Reid, N.D. Yan, D. Evans, J. Moss, y W.A. Scheider. 1977. Lluvia ácida en el centro-sur de Ontario. Ontario Ministerio de Medio Ambiente, Rexdale, ON.
Dillon, P.J., N.D. Yan, W.A. Schieder, y N. Conroy. 1979. Lagos ácidos en Ontario, Canadá: Caracterización, extensión y respuestas a adiciones de base y nutrientes. Archivos de Hidrobiología, Supl. 13:317-336.
Dixit, S.S., A.S. Dixit, y J.P. Smol. 1991. Inferencias ambientales multivariadas basadas en ensamblajes de diatomeas de lagos de Sudbury (Canadá). Biología del Agua Dulce, 26:251-266.
Medio Ambiente Canadá. 1996. El medio ambiente del Estado de Canadá. Gobierno de Canadá, Ottawa, ON.
Medio Ambiente Canadá. 1998. Evaluación de lluvia ácida canadiense. Volumen 1. Resumen de Resultados. Medio Ambiente Canadá, Ottawa, ON.
Medio Ambiente Canadá. 2005. Evaluación canadiense de la ciencia de deposición ácida 2004. Servicio Meteorológico de Canadá, Downsview, ON. http://publications.gc.ca/pub?id=9.688243&sl=0
Medio Ambiente Canadá. 2014. Inventario Nacional de Liberación de Contaminantes y Resúmenes y Tendencias de Emisiones Contaminantes del Aire. Medio Ambiente Canadá, Ottawa, ON. http://www.ec.gc.ca/inrp-npri/default.asp?lang=en&n=0EC58C98-1#Emission_Summaries Consultado en enero de 2015.
Agencia de Protección Ambiental (EPA). 2011. Informe del Programa Nacional de Evaluación de Precipitaciones Ácidas al Congreso 2011: Una Evaluación Integrada. US EPA, Research Triangle Park, Carolina del Norte. Consultado en enero de 2014.
Agencia de Protección Ambiental (EPA). 2014. Tendencias Aéreas. US EPA, Research Triangle Park, Carolina del Norte. https://www.epa.gov/air-trends Consultado enero, 2014.
Findlay, D.L. y S.E.M. Kasian. 1986. Respuestas de la comunidad de fitoplancton a la acidificación del lago 223, Área Experimental Lakes, noroeste de Ontario. Contaminación del Agua, Aire y Suelo, 30:719-726.
Freda, J., W.J. Sadinski, y W.A. Dunson. 1991. Monitoreo a largo plazo de poblaciones de anfibios con respecto a los efectos de la deposición ácida. Contaminación del Agua, Aire y Suelo, 55:445-462. Freedman, B. 1995. Ecología Ambiental. 2a ed. Prensa Académica, San Diego, CA.
Freedman, B. y T.A. Clair. 1987. Balances de masa iónica y flujos estacionales de cuatro arroyos ácidos de aguas marrones en Nueva Escocia. Revista Canadiense de Pesca y Ciencias Acuáticas, 44:538-548.
Gerhardsson, L., A. Oskarsson, y S. Skerfving. 1994. Precipitación ácida — efectos sobre los oligoelementos y la salud humana. Ciencia del Medio Ambiente Total, 153:237-245.
Godbold, D.L. y A. Huttermann (eds.). 1994. Efectos de la Lluvia Ácida en Procesos Forestales. Wiley-Liss, Hoboken, Nueva Jersey.
Harvey, H.H. y C. Lee. 1982. Cambios históricos de la pesca relacionados con los cambios de pH de las aguas superficiales en Canadá. Pág. 45-55 en: Actas del Simposio Internacional sobre Lluvia Ácida y Pesca.
Henriksen, A. 1980. Acidificación de aguas dulces — una valoración a gran escala. Pág. 68-74 en: Impactos Ecológicos de la Precipitación Ácida, (D. Drablos y A. Tollan, eds.). Proyecto SNSF, Oslo, Noruega.
Jeffries, D.S., T.G. Brydges, P.J. Dillon, y W. Keller. 2003. Seguimiento de los resultados de los programas de control de lluvia ácida Canadá/Estados Unidos; algunas respuestas de lagos. Monitoreo y Evaluación Ambiental, 88:3-19.
Joskow, P.L., A.D. Ellerman, J.-P. Montero, R. Schmatensee, y E.M. Bailey. 2000. Mercados para Aire Limpio: El Programa de Lluvia Ácida de Estados Unidos. Cambridge University Press, Cambridge, Reino Unido.
Kelly, C.A., J.W.M. Rudd, A. Furutani, y D.W. Schindler. 1984. Efectos de la acidificación lacustre sobre las tasas de descomposición de la materia orgánica en sedimentos. Limnología y Oceanografía, 29:687-694.
Kerekes, J. y B. Freedman. 1988. Características físicas, químicas y biológicas de tres cuencas hidrográficas en el Parque Nacional Kejimkujik, Nueva Escocia. Archivos de Contaminación Ambiental y Toxicología, 18:183-200.
Kerekes, J., B. Freedman, G. Howell, y P. Clifford. 1984. Comparación de las características de un lago eutrófico ácido y un lago oligotrófico ácido cerca de Halifax, Nueva Escocia. Water Pollution Research Journal of Canada, 19:1-10.
Lacroix, G.L. y D.R. Townsend. 1987. Respuestas del salmón atlántico juvenil (Salmo salar) a aumentos episódicos en la acidez de los ríos de Nueva Escocia. Revista Canadiense de Pesca y Ciencias Acuáticas, 44:1475-1484.
Linzon, S.N., y P.J. Temple. 1980. Remuestreo de suelos y mediciones de pH después de un periodo de 18 años en Ontario. Pp. 176-177 en: Impacto Ecológico de la Precipitación Ácida, (D. Drablos y A. Tollan, eds.). Proyecto SNSF, Oslo, Noruega.
Lovett, G.M., W.A. Reiners, y R.K. Olson. 1982. Deposición de gotas nubosas en bosques de abetos balsámicos subalpinos: Presupuestos hidrológicos y químicos. Ciencia, 218:1303-1304.
Malley, D.F., D.L. Findlay, y P.S.S. Chang. 1982. Efectos ecológicos de la precipitación ácida sobre el zooplancton. Pp. 297-327 en: Efectos de la precipitación ácida en sistemas ecológicos (F.M. D'Itrii, ed.), Ann Arbor Science, Ann Arbor, MI.
Mills, K.H. 1984. Respuestas de la población de peces a la acidificación experimental de un pequeño lago Ontario. Pp. 117-131 en: Respuestas bióticas tempranas al avance de la acidificación del lago (G.R. Hendry, ed.). Butterworth, Toronto.
Mills, K.H., S.M. Chalanchuk, L.C. Mohr, e I.J. Davies. 1987. Respuestas de poblaciones de peces en Lago 223 a 8 años de acidificación experimental. Revista Canadiense de Pesca y Ciencias Acuáticas, 44, Supl. 1, 114-125.
Morrison, I.K. 1983. Composición del percolado a partir de perfiles reconstruidos de suelos de bosque de pino gato influenciado por el aporte ácido. Pág. 195-206 en: Efectos de Acumulaciones de Contaminantes del Aire en Ecosistemas Forestales. (B. Ulrich y J. Pankrath, eds.). Reidel, Berlín, Alemania.
Recursos Naturales Canadá. 1998. Efectos de la deposición ácida en los bosques de Canadá. Recursos Naturales Canadá, Ottawa, ON.
Okland, J. y K.A. Okland. 1986. Los efectos de la deposición ácida en animales bentónicos en lagos y arroyos. Experimentia, 42:471-486.
Parker, G.R., M.J. Petrie, y D.T. Sears. 1992. Distribución de aves acuáticas en relación con la acidez de los humedales. Diario de Manejo de Vida Silvestre, 56:268-274.
Percy, K.E. 1986. Efectos de la lluvia ácida simulada sobre la capacidad germinativa, el crecimiento y la morfología de las plántulas forestales. Nueva Fitóloga, 104:473-484.
Reuss, J.R. y D.W. Johnson. 1985. Efecto de los procesos del suelo sobre la acidificación del agua por precipitación ácida. Revista de Calidad Ambiental, 14:26-31.
Ro, C.U. 2014. Se analizaron los campos de datos de la Base Nacional de Datos de Química Atmosférica (NatChem) y la División de Investigación de Calidad del Aire, Medio Ambiente Canadá, Toronto, ON. www.msc—smc.ec.gc.ca/natchem (Proporcionado como una comunicación personal.)
Rose, J. (ed.). 1994. Lluvia Acida: Situación Actual y Remedios. Gordon & Breach Science Publishers, Yverdon, Suiza.
Scheider, W.A., D.S. Jeffries, y P.J. Dillon. 1980. Deposición a granel en las áreas de Sudbury y Muskoka—Haliburton de Ontario durante el cierre de INCO Ltd. en Sudbury. Ontario Ministerio de Medio Ambiente, Rexdale, ON.
Schindler, D.W. 1988. Efectos de la lluvia ácida en ecosistemas de agua dulce. Ciencia, 239:149-157. Schindler, D.W. 1990. Perturbaciones experimentales de lagos enteros como pruebas de hipótesis sobre la estructura y función de los ecosistemas. Oikos, 57:25-41.
Schindler, D.W., K.H. Mills, D.F. Malley, D.L. Findlay, J.A. Shearer, I.J. Davies, M.A. Turner, G.A. Linsey, y D.A. Cruikshank. 1985. Estrés ecosistémico a largo plazo: los efectos de años de acidificación experimental en un lago pequeño. Ciencia, 228:1395-1401.
Schofield, C.L. 1982. Cambios históricos en la pesca en Estados Unidos relacionados con disminuciones en el pH de las aguas superficiales. Pág. 57-67 en: Actas del Simposio Internacional sobre el Ácido. Lluvia y Pesca. Sociedad Americana de Pesca, Bethesda, MD.
Shannon, J.D. y B.M. Lecht. 1986. Estimación de matrices fuente-receptor para deposición de NO x —N. contaminación por agua, aire y suelo, 30:815-824.
Sprules, W.G. 1975. Comunidades de zooplancton de crustáceos de verano en lagos con estrés ácido. Revista de la Junta de Investigación Pesquera de Canadá, 32:389-395.
Stensdotter, U., T. Svenson, U. Larsson, y G. Persson. 2005. Mitigación de la acidificación en lagos por encalado. Estudios Integrados de los Efectos del Encalado de Aguas Acidificadas, Agencia Sueca de Protección Ambiental, Estocolmo, Suecia.
Stewart, C.C. y B. Freedman. 1989. Comparación de las comunidades macrófitas de un lago oligotrófico de aguas claras y un lago oligotrófico de aguas marrones en el Parque Nacional Kejimkujik, Nueva Escocia. Contaminación del Agua, Aire y Suelo, 46:335-341.
Tveite, B. 1980. Efectos de la precipitación ácida sobre suelo y bosque. 9. Crecimiento de árboles en experimentos de campo. Pp. 206-207 en: Impacto Ecológico de la Precipitación Ácida (D. Drablos y A. Tollan, eds.). Proyecto SNSF, Oslo, Noruega.
Watmough, S.A. y P.J. Dillon. 2004. Flujos de elementos principales de una cuenca de coníferas en el centro de Ontario, 1982-1999. Biogeoquímica, 67:369-398.
Watt, W.D., C.D. Scott, y W.J. White. 1983. Evidencia de acidificación de algunos ríos de Nueva Escocia y su impacto en el salmón del Atlántico. Revista Canadiense de Pesca y Ciencias Acuáticas, 40:462-473.
Wood, T. y F.H. Bormann. 1976. Efectos a corto plazo de una lluvia ácida simulada sobre el crecimiento y las relaciones nutrimentales de Pinus strobus. Pág. 815—824 en: Informe Técnico General NE-23, Estación Experimental Forestal Noreste, Servicio Forestal de la U.S.D.A., Upper Darby, PA.
Wright, R.F. y E. Snekvik. 1978. Precipitación ácida: Química y poblaciones de peces en 700 lagos del extremo sur de Noruega. Verhandlungen der Internationalen Vereinigung für Theoretische und Angewandte Limnologie, 20:765-775.
Yan, N.D., R.E. Girard, y C.J. Lafrance. 1979. Supervivencia de Trucha Arco Iris, Salmo gairdneri, en Recintos Sumergidos en Lagos Tratados con Agentes Neutralizantes cerca de Sudbury, Ontario. Ontario Ministerio de Medio Ambiente, Rexdale, ON.


