Deficiencia de adenilosuccinato liasa
| Deficiencia de adenilosuccinato liasa | ||
|---|---|---|
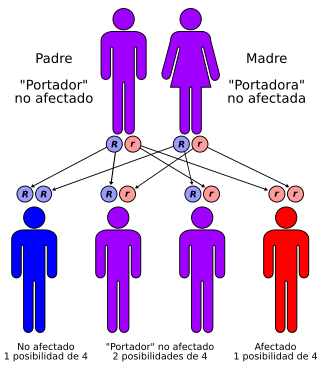 La deficiencia de adenilsuccionato liasa se transmite con un patrón autosómico recesivo | ||
| Síntomas | Comportamiento agresivo, Microcefalia | |
| Causas | Falta de la enzima adenilosuccinato liasa | |
Deficiencia de la adenilosuccinato liasa, también llamada Deficiencia de adenilosuccinasa,[1] es una rara enfermedad metabólica autosómica recesiva[2] caracterizada por la aparición de 5-succinil-amino-4-imidazol-carboxamida ribósido (SAICAr) y succiniladenosina (S-Ado) en el fluido cerebroespinal, orina, y en menor grado en el plasma sanguíneo.[3]
Estas dos purinas succinilo son los derivados desfosforilados del ribótido SAICAr y adenilosuccinato (S-AMP), ambos de la adenilosuccinato liasa (ASL) que cataliza una importante reacción en la ruta de la biosíntesis de las purinas. ASL cataliza dos reacciones distintas en la síntesis de los nucleótidos de la purina donde ambas involucran la β-eliminación de fumarato para producir aminoimidazol carboxamida ribósido (AICA) a partir de SAICAr o de S-AMP.
Patofisiología[editar]
Esta deficiencia es responsable de una serie de síntomas que incluyen retraso psicomotor, generalmente acompañado de convulsiones epilépticas y rasgos autistas. La mayoría de los pacientes tienden a presentar un retraso moderado a severo, mientras que un menor porcentaje de los pacientes sólo presentan un leve retraso mental.
Se propusieron dos teorías para explicar los efectos. La primera de ellas explica que los síntomas se dan por la disminución de la concentración de nucleótidos de purina que se necesita para la biosíntesis de las purinas. La disminución de las concentraciones, sin embargo, no se pudo encontrar en diversos tejidos tomados de pacientes con deficiencia de ASL[3] probablemente porque las purinas están decoradas a través de la vía de recuperación de purinas y alguna actividad residual de ASL.
La segunda es la acumulación de succinilpurinas, la cual causa efectos neurotóxicos. En los pacientes gravemente afectados, los niveles de concentración de SAICA ribósido y S-Ado son comparables, mientras que en los pacientes con formas más leves de la enfermedad, la proporción de S-Ado es más del doble de la de los más severamente afectados, mientras que la concentración de los niveles de SAICA ribósido siguen siendo comparables. Esto sugiere que el SAICA ribósido es el principal contribuyente, mientras que S-Ado puede proteger contra los efectos tóxicos del SAICA ribósido.[3]
Los estudios bioquímicos de la enzima se han centrado en proteínas de ASL de especies no humanas. La estructura de la forma cristalizada de ASL de Thermotoga maritima se ha usado, junto con datos de secuenciación de ADN, para la construcción de modelos de homología para una variedad de otros organismos, incluyendo ASL humana.[4]
Una variedad de estudios se han realizado utilizando la enzima equivalente de Bacillus subtilis, que comparte el 27% de identidad a lo largo con aproximadamente el 17% de similitud en la secuencia de aminoácidos con la enzima humana.[4] La homología de modelos superpuestos unos sobre otros muestran un alto grado de solapamiento entre las enzimas. La familia de enzimas a la que pertenece ASL y que catalizan-eliminaciones en la que el fumarato es uno de los productos son homotetrámeros con cuatro sitios activos compuestos de residuos de aminoácidos de tres subunidades distintas.[5]
Se sabe mucho sobre el sitio activo de ASL humano debido a los estudios del sitio activo en los B. subtilis ASL a través de marcaje por afinidad y mutagénesis dirigida al sitio. Aunque hay un poco de variabilidad entre especies en la secuencia de ASL, el sitio activo de la enzima contiene muchos residuos que se conservan entre las especies y que han demostrado ser críticos para la función de las enzimas. His68 y His141 parecen servir como el ácido general y catalizador básico general, respectivamente, y son fundamentales para catalizar la reacción del sustrato.[6] His89 parece mejorar la unión del grupo fosforilo sustratos y orientar adenilosuccinato para la catálisis.[7]
Las tres histidinas se conservan a lo largo de las 28 especies de las que se conoce la estructura del ASL. Se ha demostrado que Glu275 y Lys268 también contribuyen al sitio activo, lo que indica que hay cuatro sitios activos, cada uno de los cuales se forman a partir de regiones de tres subunidades.[5]
La deficiencia de ASL en diferentes pacientes a menudo es causada por diferentes mutaciones en la enzima. Más de 30 mutaciones diferentes en el gen de la ASL se han descubierto en todo el mundo. Las mutaciones que resultan en esta deficiencia se extienden por toda la enzima, con la mayoría situadas lejos del sitio activo, lo que sugiere que la inestabilidad térmica, en lugar del deterioro catalítico del sitio activo, es la causa más frecuente de la deficiencia.[8]
Historia[editar]
A partir de 2004, cerca de 60 pacientes habían sido diagnosticados con deficiencia de ASL, pero se cree que existen muchos más y no son diagnosticados, debido a la heterogeneidad de la enfermedad y la escasez de investigación general. Los pacientes que han sido diagnosticados en una serie de diferentes áreas en todo el mundo, aunque un gran número de ellos son de los Países Bajos. La deficiencia de ASL saltó a la fama en el caso bien documentado de Michael Dignan, un joven con discapacidades mentales. .[cita requerida] Aún no hay cura para esta deficiencia.
Referencias[editar]
- ↑ OMIM 103050
- ↑ Nassogne, M; Henrot, B; Aubert, G; Bonnier, C; Marie, S; Saint-Martin, C; Van, Den, Berghe, G; Sébire, G; Vincent, M (septiembre de 2000). «Adenylosuccinase deficiency: an unusual cause of early-onset epilepsy associated with acquired microcephaly». Brain & development 22 (6): 383-6. ISSN 0387-7604. PMID 11042421. doi:10.1016/S0387-7604(00)00154-6.
- ↑ a b c Jaeken and Van den Berge, "Adenylosuccinate Lyase Deficiency", The Metabolic and Molecular Bases of Inherited Diseases, Vol. 2, 8th ed., McGraw-Hill; New York, 2001.
- ↑ a b Palenchar JB, Crocco JM, Colman RF (2003). «The characterization of mutant Bacillus subtilis adenylosuccinate lyases corresponding to severe human adenylosuccinate lyase deficiencies». Protein Sci. 12 (8): 1694-705. PMC 2323956. PMID 12876319. doi:10.1110/ps.0303903. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b Brosius JL, Colman RF (2002). «Three subunits contribute amino acids to the active site of tetrameric adenylosuccinate lyase: Lys268 and Glu275 are required». Biochemistry 41 (7): 2217-26. PMID 11841213. doi:10.1021/bi011998t.
- ↑ Lee TT, Worby C, Bao ZQ, Dixon JE, Colman RF (1999). «His68 and His141 are critical contributors to the intersubunit catalytic site of adenylosuccinate lyase of Bacillus subtilis». Biochemistry 38 (1): 22-32. PMID 9890879. doi:10.1021/bi982299s.
- ↑ Brosius JL, Colman RF (2000). «A key role in catalysis for His89 of adenylosuccinate lyase of Bacillus subtilis». Biochemistry 39 (44): 13336-43. PMID 11063569. doi:10.1021/bi001488j.
- ↑ Sivendran S, Patterson D, Spiegel E, McGown I, Cowley D, Colman RF (2004). «Two novel mutant human adenylosuccinate lyases (ASLs) associated with autism and characterization of the equivalent mutant Bacillus subtilis ASL». J. Biol. Chem. 279 (51): 53789-97. PMID 15471876. doi:10.1074/jbc.M409974200.
